Meduloblastom (dále “MB”) má podle současné klasifikace 4 různé varianty:
- Wnt Nejvíce u dětí, méně u dospělých, téměř vůbec u kojenců. Pacienti s Wnt tumory mají nejlepší vyhlídky na přežití = jde o nejlépe léčitelnou formu.
- Shh (Sonic Hedgehog). Bývá spojena se ztrátou funkce tumor supresor genů SUFU a PTCH1. Bez těchto strážců se aktivita Shh dráhy vymyká kontrole. Shh je nejčastěji přítomna u dospělých a kojenců.
- Group 3 Častá u dětí a kojenců, minimálně u dospělých; častá amplifikace c-MYCu; nejvyšší riziko metastáz a nejhorší prognóza v porovnání s ostatními skupinami.
- Group 4 Je nejčastější variantou u dětí, ale málo častá u kojenců (0-3 roky). Celkově jde o nejčastěji diagnostikovanou variantu u MB.
Zdroj pro četnosti výskytu Kool, 2012 viz níže
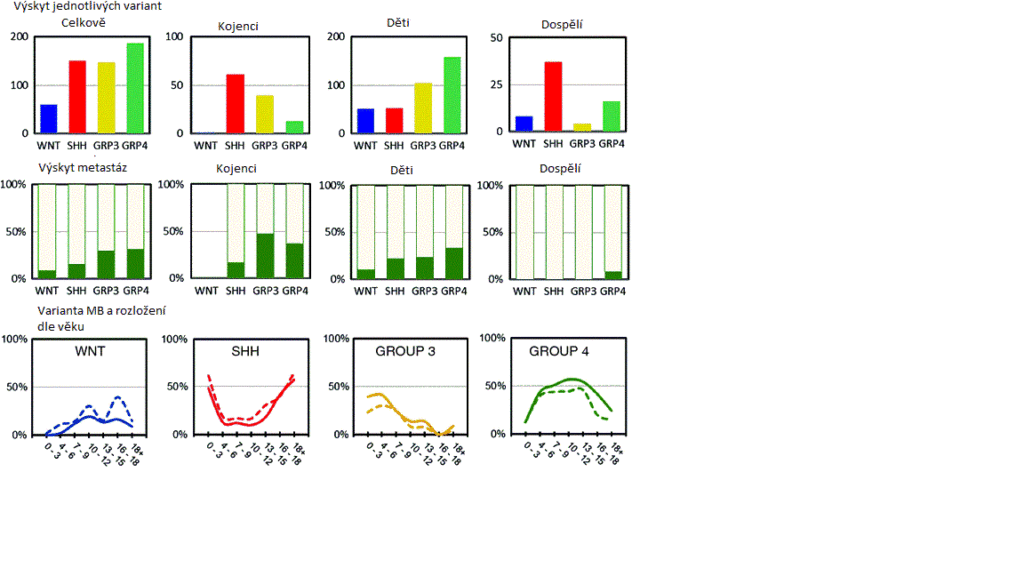 Varianta meduloblastomu může rozhodovat o tom jaká léčba je potenciálně účinná (Taylor, 2012). Podrobněji lze varianty popsat přibližně takto:
Varianta meduloblastomu může rozhodovat o tom jaká léčba je potenciálně účinná (Taylor, 2012). Podrobněji lze varianty popsat přibližně takto:

Hlavní terapeutické cíle jsou Shh, Wnt/beta catenin, Notch, Receptor Tyrosine Kináza (ERB, IGF-IR, c-MET, PDGF, Estrogen, p75NTR) a PI3K/AKT, c-MYC, STAT3 aj. (Ajeawung, 2012).
Při aplikaci radioterapie lze prozkoumat možnost využít protonovou léčbu v ČR (odkaz). Meduloblastom u dětí byl v roce 2014 navržen jako jedna z diagnóz, které by mohly být hrazeny z pojištění. Protonová terapie zřejmě vede k menším vedlejším účinkům léčby než fotonová a tedy k vyšší kvalitě života pacientů (Vega, 2013; Yock, 2016). Léčebný účinek protonové a fotonové terapie je zhruba stejný, nicméně dlouhodobé následky ozařování mají významný negativní dopad na pacienty a kvalitu jejich života. Nicméně, rozdíl je zřejmě malý a spolurozhodují i další faktory, jako např. vzdálenost od bydliště, nabídka po-zákrokové péče/asistence při zvládání nežádoucích účinků apod.
Další zajímavé informace:
- dlouhodobá prognóza pacientů v horizontu 30 let od vyléčení King, 2014
- rizika u vyléčených dětí (Packer, 2012).
Hlavní témata článku
Procesy v nádorové buňce a jejich terapeutické cíle
Inhibitory angiogeneze
Inhibice sonic hedgehog signální cesty (Shh)
Důležitá role lidského cytomegaloviru (HCMV) u nádorů mozku (aplikace léku Valganciclovir)
Přehled a doporučení alternativních doplňků k léčbě (kurkumin, EGCG, perillyl alcohol, sulphoraphane aj.)
Další náměty (mebendazole, thymoquinone, DHA/EPA aj.)
Terapeutické cíle u Group 4
MEMMAT – složení léčebného protokolu a návrhy synergických látek
Procesy v nádorové buňce a jejich terapeutické cíle
Následující výčet je přehledem potenciálních cílů pro léčebný zásah. Potenciální cíle se mezi jednotlivými typy meduloblastomu liší. V podstatě jde o 4 různé nemoci, které spolu sdílejí jen některé společné charakteristiky. Teoretický podklad je velmi odborný, ale je nezbytně nutný, pokud chceme pro pacienta vybrat doplňky k léčbě přesně na míru jeho konkrétní diagnóze. Podle zjištěné varianty MB a výsledků genové analýzy se pak z informací níže vyloví ty, které odpovídají MB u konkrétního pacienta.
- ztráta aktivity tumor supresor genu PTCH1 (Charron, 2016) se týká zejména Shh varianty. Důsledkem je vyhnutí se buněčnému stárnutí (senescence); dalším následkem je zvýšená aktivita N-myc a CyclinD1. Obojí vede u MB ke zhoršení prognózy. Tumor supresor PTCH1 reguluje Shh. Pokud je u ale u meduloblastomu mutován, SHH aktivita se vymyká kontrole. Dalším regulátorem Shh je SUFU (Brugieres, 2012). Potenciální léčebný zásah může vést u potlačení CyclinD1 aktivity přes užití mTor inhibitorů, HDAC a CDK inhibitorů např. CDK 4/6 (Sangar, 2013).
- mutace tumor supresoru p53 (Tabori, 2010) má negativní vliv na dobu přežití pacientů a zvyšuje četnost relapsů. Pro reaktivování funkce p53 lze zkusit nasadit luteolin.
- kombinace mutace v p53 a Myc je často přítomná u relapsu MB (Hill, 2014)
- PGF (druh VEGF; placental growth factor) využívá k signalizaci Nrp1 (neutropilin 1). Je vylučován u většiny meduloblastomů a koreluje s horší prognózou (Snuderl, 2013). U myší vedla anti-PGF léčba k menším nádorům. Léčba látkami TB403 a 5D11D4 vedla u myší k ústupu nádorů. Další informace Rogers, 2013. Autoři měli k dispozici 72 vzorků MB a expresi PGF zjistili až u 90% z nich.
- postup nádoru je podporován proteiny Bcl-2 a MMP-9, které jsou oba regulovány NF-kB. Vhodné je tedy nasazení NF-kB inhibitorů (např. kurkumin; Kansra, 2010). Specificky MMP-9 může napomáhat potlačit genistein, kurkumin, EGCG, resveratrol, extrakt z magnólie a nobiletin (Mannello, 2006)
- MB pomáhá v růstu a k metastázování aktivace STAT3 (Yan, 2016). Přírodními inhibitory (viz obrázek) jsou např. kyselina ursolová, kurkumin, AKBA (kyselina boswellová) či kapsaicin. Další možnosti zkoumá Kumar, 2013 a kromě výše zmíněných uvádí třeba i honokiol (magnólie). Furqan, 2013 zmiňuje ještě i danshen.
- zjistilo se, že šance na vyléčení také zhoršuje deaktivace tumor supresoru PTEN (Metcalfe, 2013); v tomto případě lze použít resveratrol a honokiol. Chybějící aktivita PTENu zhoršuje výsledky v léčbě inhibitory Shh a také někdy aktivuje nekontrolovaně dráhu PI3K. Autoři tedy navrhují spojit inhibitory Shh, s inhibitory PI3K. Toto lze doplnit o stimulaci PTENu. U myší nízká/chybějící aktivita PTENu korelovala horším přežitím (Castelino, 2010). Myši bez PTENu měly také 2x vyšší výskyt MB.
- často přítomné jsou hTERT mutace (Remke, 2013). Celkově u zhruba 21% pacientů s MB, nicméně až u 83% v Shh skupině (Wnt 33%, G3 a G4 pod 5%). TERT je regulátorem telomerázy. Vhodné je tedy u Shh skupiny nasadit inhibitory telomerázy nebo hTERTu. Další informace viz Shh a TERT Lindsey, 2014.
- MB je ve var. G3 a G4 poháněn onkogeny GFI1 a GFI1B (Northcott, 2014). GFI1 významně ovlivňuje STAT3 (Tavassoli, 2000) a tím pomáhá nádoru. Vhodné by zde mohly být HDAC inhibitory (Wang, 2013).
- vhodné spojení HDAC a PI3K inhibitorů (Pei, 2016) u MYC-driven MB
- růstu nádoru napomáhá onkogen Netrin-1 (Akino, 2014). Možnost jeho blokace. Dále také aktivita PERK (Ho, 2016)
- pozitivní by měla být Wip1 (také se používá název PPM1D) inhibice (Milosevic, 2015; Buss, 2015)
- u non-Shh a non-Wnt variant Morfouace považuje za nadějné léky pemetrexed a gemcitabine. Téma rozvedeno v Morfouace, 2014 pro MB var. G3
- u metastazujícího nádoru var. G3 jsou hyper aktivní Notch1 (Kahn, 2015)
- účinnost léčby tyrosin kináz inhibitory (canertinib/crizotinib) snižuje produkce HGF nádorem (Zomerman, 2014)
- u high-Myc G3 varianty MB by mohly být vhodné inhibitory glutaminolýzy (Hanaford, 2013)
- u mozkových tumorů by mohly být důležité NK buňky (Fairhead, 2014; Fernandéz, 2013). Stimulovat aktivitu a produkci NK buněk mohou reishi a shitake (Chang, 2014), asthaxantin (Sun, 2016) a česnekový extrakt (Ishikawa, 2006)
- COX-2 inhibitory a léky proti cytomegaloviru (viz dále odstavec o HCMV)
Inhibitory angiogeneze (IA)
IA jsou látky, které blokují nádorům schopnost vytvářet si nové zásobovací cévy. Jde o směr léčebného zásahu, kterým jde MEMMAT. MEMMAT je experimentální léčebný protokol, který prochází klinickým testováním a podává se v něm 7 různých léků v malých dávkách. Je určen pro pacienty s MB, u kterých došlo k návratu nemoci po prvotním vyléčení.
- pomalejší růst zásobovacích cév = pomalejší růst nádoru
Koto, 2011 nifurtimox + tetrathiomolybdate (TM) skrze inhibici SOD-1. TM je inhibitorem angiogeneze a má chelatační účinky na měď.
Brewer, 2000 se věnuje výsledkům použití TM v klinické studii. Výsledkem bylo zpomalení progresu nemoci. Možný pozitivní vliv na pravděpodobnost relapsu u rakoviny prsu (Jain, 2013).
Koncentrace SOD-1 je u meduloblastomu korelována s odpovědí na léčbu (Mori, 1996); nižší koncentrace = lepší odpověď a šance pacienta. TM je chelátorem mědi (viz níže). Tedy je otázkou, zda-li by použití léků na snížení hladin mědi mohlo být nápomocné pro účinek inhibitorů angiogeneze. Obecně se má za to, že měď je nutným prvkem pro tvorbu nových cév. Na webu je téma více popsáno v článku o Disulfiramu. Běží klinické testování řízeného navození nedostatku mědi v těle pacientů, nicméně tento směr nejspíše nebude stačit k zastavení růstu nádorů, jen k jejich zpomalení. Otázkou ale je, zda-li by nešlo o velmi vhodný doplněk k léčbe inhibitory angiogeneze. Velmi pravděpodobně ano.
Další nadějnou možností je inhibice PGF/Nrt1. Meduloblastom a PGF viz článek. Nicméně i toto téma není zcela jasné viz Xu, 2006.
U relapsu MB se úspěšně zkoušela kombinace bevacizumab + irinotecan (Aquilera, 2011) a kombinace bevacizumab, irinotecan a temozolomide (Aquilera, 2013; TEMIRI studie irinotecan + temozolomide Grill, 2013). Bevacizumab je součástí MEMMATu, ale je zde v kombinaci s etoposidem, což je látka ze stejné kategorie jako irinotecan (topoisomerase inhibitor). Etoposidu byla zřejmě dána přednost kvůli lepšímu bezpečnostnímu profilu = má méně závažných vedlejších účinků. Irinotecan výrazně potlačuje imunitu (bílé krvinky), a toto riziko v MEMMATu nese již Thalidomid.
Inhibice sonic hedgehog signální cesty (Shh)
Sonic hedgehog je, jak už napovídá i název, hlavním léčebným cílem v Shh variantě MB, do které patří zhruba 28% pacientů s MB. Prognóza léčby je někde mezi Wnt variantou (dobrá prognóza) a Group 3 variantou (špatná prognóza). Nejvíc pacientů v Shh skupině je do 4 let a nad 16 let. Nejčastější je mutace PTCH1 genu a aktivní Notch a PDGF signalizace. Nádorové buňky Shh vylučují ve velkém N-myc (DeSouza, 2014).
Zkouší se lék vismodegib (GDC-0449; studie fáze I Gajjar, 2013), u kterého se ukázalo, že zabírá pouze u pacientů s Shh+ meduloblastomem (link).
Možností je také lék Itraconazole (Kim, 2010; antimykotikum, u nás k dostání). Podrobněji téma Shh inhibitorů u pacientů s SHH+ meduloblastomem Ransohoff, 2015.
Dalším inhibitorem, který prochází klinickým testováním je Saridegib (IPI-926). Prodloužil 5x dožití u myší (Lee, 2012). Vývoj léku byl ale zastaven po neuspokojivých výsledcích ve studii fáze II u chondrosarcomu (odkaz).
Zjistilo se, že aktivní Shh dráha stimuluje receptor Boc, který koreluje s růstem nádoru (Mille, 2014; Lauth, 2014). Zvýšené hladiny Boc mohou být důvodem pro postupnou úplnou deaktivaci PTCH1.
Přírodní látky, které mají vliv na inhibici Shh viz obrázek níže. Jsou to např. resveratrol, EGCG, kurkumin a genistein (Huang, 2013). Dále je zmiňován berberine (Wang, 2015). Berberine v pokusu ve zkumavce fungoval proti buňkám meduloblastomu.
Role Nrf2
Koncentrace Nrf2 v nádorových buňkách primárních mozkových tumorů korelují se stádiem nemoci. Čím vyšší stádium, tím více Nrf2 proteinů v nádorových buňkách (Tsai, 2016). To by mohlo vést k závěru, že během onkologické léčby (a před) bude vhodné nasadit inhibitory Nrf2, které by mohly zvýšit účinnost léčby, neboť jde o případ, kdy nádor hacknul funkci Nrf2 a využívá ji ve svůj prospěch – tedy na ochranu před léky či radioterapií. Podrobně o Nrf2 viz článek na tomto webu. Týká se zejména léčby chemoterapií v první fázi. Luteolin je inhibitorem Nrf2, který je schopen se dostat do mozku (Tan, 2014).
Důležitá role lidského cytomegaloviru (HCMV) u nádorů mozku
Zdá se, že u některých rakovin může hrát velkou roli to, když jsou nádorové buňky infikovány cytomegalovirem. Tato situace může vést k tomu, že takto nakažená buňka vykazuje mnohem vyšší nádorovou agresivitu. U rakovin je zatím nejprokázanější souvislost u nádorů mozku, kde zdá se nádorová buňka žije s HCMV v jakémsi druhu symbiózy.
Cytomegalovirus je celosvětově rozšířený virus patřící do skupiny herpetických, který je všudypřítomný. Nakaženost se pohybuje mezi 50-100% dospělých (v některých rozvojových zemích může být nakaženo až téměř 100% dospělých). Nákaza je u dospělých bezpříznaková a dobře fungující imunitní systém udržuje virus pod kontrolou. Jde o tzv. latentní infekci, kdy se virus schovává v těle před imunitou a číhá na svou chvíli slávy – na moment, kdy u hostitele dojde k výraznému oslabení imunity. V takovou chvíli vylezou viry ze svých skrýší a udeří.
V případě rakoviny ale lidský imunitní systém nefunguje, protože nádorové buňky se umějí před imunitou schovat nebo ji různě obelstít. Když CMV napadne nádorovou buňku, tak imunita nemá jak zasáhnout – a nádorová buňka se ani nijak nebrání. Vše nasvědčuje tomu, že nádorová buňka a virus v sobě našly zalíbení. Buňka umožňuje viru se v ní dle libosti množit, což viry dělají ze všeho nejraději a hlavně, jako bonus přiloží ochranu před imunitou, která virus během množících orgií nijak neotravuje. Virus za odměnu dělá pro nádor různé protislužby, zejména vylučuje různé proteiny, které mají nádory rády a které používají jako stimulanty k růstu (např. enzym COX-2; přehled v Halenius, 2014). V posledních letech se zjišťuje, že CMV může hrát důležitou roli nejen u rakovin, ale i u řady dalších nemocí např. lupusu a jiných autoimunitných onemocnění (článek na ME).
Johnsen, 2015 zkoumali přítomnost CMV v nádorových buňkách mozkových nádorů. Zjistili, že u myší s glioblastomem, kde byl přítomen CMV virus, se postup rakoviny zpomalil a prodloužilo se přežití, pokud byly myším podány léky proti CMV.
U lidských vzorků meduloblastomu, které zkoumali,
našli CMV a jeho proteiny u 92% meduloblastomů a 99% glioblastomů.
Tedy téměř všechny nádorové buňky byly nakaženy virem. To je zcela zásadní zjištění.
Teorii vlivu CMV nasvědčuje i studie Deng, 2004, která zkoumala 52 vzorků meduloblastomu a u 51 z nich zjistila mírnou až silnou aktivitu COX-2. Cytomegalovirus vylučuje COX-2 při své replikaci (Hooks, 2006). Vysoká aktivita COX-2 u některých rakovin tak může naznačovat spojitost s replikační aktivitou CMV. Odměnou za to, že nádorová buňka umožňuje CMV mohutnou ničím nerušenou replikaci, se z virusu na oplátku stává 24/7 jedoucí továrna na enzym COX-2, který je pro rakoviny něco jako hnojivo.
Další informace o roli CMV v MB viz článek. Autoři docházejí k závěru, že sice zacílení na likvidaci CMV nevyléčí rakovinu, ale odstranění CMV z nádorů může značně ovlivnit (zpomalit) jejich schopnost růst. K závěru, že CMV ovlivňuje mozkové nádory a že je přítomen u většiny z nich, došli i Dziurzynski, 2012.
Baryawno, 2011 použili COX-2 inhibitor a prokázali 72%-97% zmenšení MB nádoru v pokusu ve zkumavce a v pokusu na myších.
Silnou spojitost rychlosti postupu glioblastomu s infekcí CMV prokázali na myších i Lee, 2015.
Stragliotto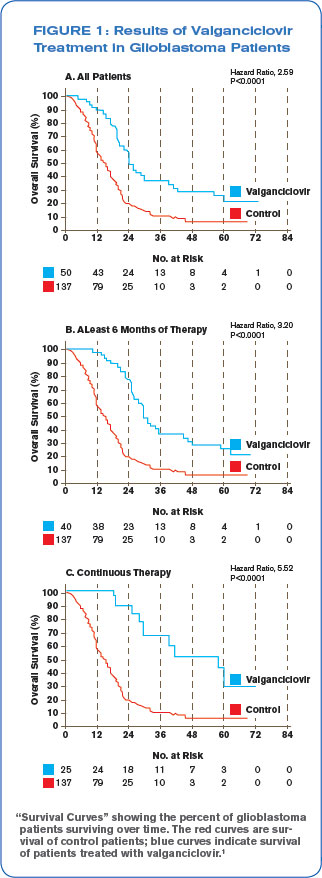 , 2013 je první klinická studie u pacientů s glioblastomem, kdy byla testována teorie jestli se přidání léku proti CMV Valgancicloviru nějak projeví na výsledcích léčby (42 pacientů, náhodně rozdělených do dvou skupin: experimentální, kde dostávali lék a kontrolní, kde dostávali placebo; design studie byl dvojitě slepý, tedy ani pacient, ani podávající lékař nevědí, jestli pacient dostává lék nebo placebo).
, 2013 je první klinická studie u pacientů s glioblastomem, kdy byla testována teorie jestli se přidání léku proti CMV Valgancicloviru nějak projeví na výsledcích léčby (42 pacientů, náhodně rozdělených do dvou skupin: experimentální, kde dostávali lék a kontrolní, kde dostávali placebo; design studie byl dvojitě slepý, tedy ani pacient, ani podávající lékař nevědí, jestli pacient dostává lék nebo placebo).
Po 3 měsících nádory ve Valganciclovir skupině rostly v průměru o 3.58 cm3, kdežto v kontrolní skupině o 7.44 cm3. Po 6 měsících užívání o 3.31, kdežto v kontrolní skupině o 13.75 cm3. Výsledek ukazuje jasný vliv léčby CMV na schopnost nádoru růst.
I celkové přežití byly delší ve Valganciclovir skupině (17,7 měsíců vs 13,7). U pacientů, kteří užívali lék min. 6 měsíců (a dále) byla ještě více než polovina pacientů naživu i po 24 měsících. 6 z 22 pacientů ve skupině s lékem bylo naživu ještě i po 4 letech od diagnózy, což je u glioblastomu velmi vzácné. Konkrétně, 27,3% pacientů, kteří užívali lék 6+ měsíců, bylo naživu ještě po 4 letech, kdežto průměrné přežití u běžné léčby v té době bylo 5,9%.
Další klinickou studií je Söderberg-Nauclér, 2013. 50 pacientům s glioblastomem byl k léčbě přidáván Valganciclovir. Po 2 letech bylo naživu ještě 62% pacientů (u srovnatelných pacientů a diagnóz se v té době pohybovalo 2leté přežití kolem 18% při standardní léčbě). Mediánové přežití bylo 25 měsíců (kontrolní skupina 13,5). Přežití se zvýšilo pokud byli pacienti schopni brát lék alespoň 6 měsíců a dále. 25 pacientů pokračovalo v braní léku i po 6 měsících, jejich 2leté přežití bylo 90% a mediánové celkové přežití 56,4 měsíců.
Výsledky potvrzuje i Rahbar, 2012. Autoři zkoumali míru přítomnosti infekce CMV v nádorových buňkách glioblastomu a vliv tohoto na dobu přežití pacientů. U těch, kteří přežili přes 18 měsíců, převládala nízká úroveň infekce.
Možnost nasadit léky proti CMV u nádorů mozku sebou nese zdá se úžasný potenciál. Z léků by se nasadil nejspíše Valganciclovir, neboť jsou již k dispozici klinické studie. Dalším lékem, který se používá je Ganciclovir. Rozdíl je minimální. Valganciclovir je tzv. pro-drug a v játrech se mění na ganciclovir. U nás je k dostání pod obchodním názvem Valcyte 450mg od TEVA. Jde o lék na předpis.
Optimální by bylo spojit lék proti CMV s podáním inhibitorů COX-2. Z přírodních látek to jsou kurkumin, genistein, Tripterygium wilfordii, EGCG, resveratrol, quercetin, salicin z vrby bílé (Salix alba) a také carnosol (látka v šalvěji, rozmarýnu). Z léků ty z kategorie NSAID (třeba aspirin a ibuprofen).
COX-2 inhibitor celecoxib se zkoumal ve zkumavce a na myších a závěrem bylo, že zvýšil radiosenzitivitu MB buněk. Nicméně lepší výsledky u myší lze hledat i v samotném účinku COX-2 inhibice, nikoliv ve zvýšeném účinku ozářování (Chen, 2010).
Přírodní alternativy k lékům proti CMV, které by teoreticky mohly fungovat jsou např. kopřiva (Urtica dioica), extrakt z česneku, Terminalia chebula, extrakt zázvoru, extrakt z mořských řas a olej z černuchy seté (Nigella sativa; black cumin seed oil). Olej z černuchy v pokusu na myších dokázal zlikvidovat virus již po 10 denním užívání. Oproti účinnosti Valgancicloviru ale půjde nejspíše o mnohem slabší působení. Jde pouze o tipy pro případ, že by nebylo možno lék sehnat na předpis.
Role CMV se zkoumá i u jiných rakovin. Zdá se, že může být výrazná např. u rakoviny prsu (Richardson, 2015), kde může navíc hrát roli i Epstein-Barr virus (EBV). Z tohoto pohledu je důležité, že Valganciclovir účinkuje i proti EBV. Ahmed, 2016 zkoumal vzorky 107 pacientek, a CMV pozitivních bylo 43,9% vzorků. Situace a role CMV u rakoviny prsu je ale ještě nejasná (Herbein, 2014).
Zřejmě zásadní je vliv CMV u mozkových metastáz u rakoviny prsu a kolorektálního karcinomu. Taher, 2014 zkoumali vzorky 78 pacientů a jejich mozkové metastázy měly CMV pozitivní protein u 99% vzorků. Vysoké hodnoty proteinů korelovaly s nižším celkovým přežitím a kratším úsekem pro opětovný postup nemoci.
Vliv HCMV na jednotlivé rakoviny ale může být různý, výjimečně může být i protinádorový jak naznačil pokus na hlodavcích u rakoviny jater (Kumar, 2016). HCMV působí zřejmě u každého člověka stejně, ale rakoviny se velmi odlišují v tom co jim vyhovuje a co ne.
Nejsou k dispozici data o úloze CMV u rakoviny plic. U rakoviny plic jsou zajímavostí pouze případy kdy plicní infekce CMV vypadá jako plicní nádor (Allen, 2005; Ryu, 2003; Rao, 2012). Data pro rakovinu děložního čípku (Marinhi-Dias, 2013). CMV u kolorektálního karcinomu (Damberg, 2013; Ameli, 2015; Mariguela, 2008).
HCMV může škodit například tak, že stimuluje aktivitu NF-kB (El-Shinawi, 2013) a aktivuje JAK/STAT signální dráhu (Oseguera, 2012). Aktivace STAT3 může činit rakovinu více invazivní a zvyšovat metastatický potenciál. Zvyšuje produkci MMP-10 (Bishop, 2015) – MMP-10 enzym zvyšuje životaschopnost nádorových buněk a napomáhá jejich metastatické aktivitě. A již jsem zmínil roli enzymu COX-2.
CMV pozitivní vs negativní nález má vliv i na délku přežití pacientů po transplantaci (Desai, 2015). Pokud byl dárce i příjemce CMV negativní, měl příjemce statisticky mnohem delší dobu přežití (měřilo se přežití po 10 letech od transplantace) než pokud měl jeden z nich nebo oba CMV pozitivní (P < 0.0001).
Shrnutí celého tématu je také v článku od Life Extension. Další informace Cinatl, 2015.
Přehled a doporučení alternativních doplňků k léčbě
Redukce mědi
Redukce hladin mědi by měla mít vliv na tvorbu nových zásobovacích cév k nádorům (angiogenezi). Měď je pro angiogenezi nutná. Turecký, 1984 zjistil u pacientů s mozkovými nádory vyšší hladiny mědi a ceruloplasminu v krevním séru. Ceruloplasmin je bílkovina, která se tvoří v játrech a podílí se na transportu mědi v krvi. Také Yoshida, 1993 nachází zvýšené koncentraci mědi v nádorových buňkách.
Více k mědi a možnostem její redukce v článku o disulfiramu. Lze se pokusit redukovat omezením příjmu ve stravě nebo přidáním chelatujících látek. V klinických studiích se dají nasadit speciální léky, které mají silnější účinek, ale je třeba, aby byl pacient pod dohledem a hladiny ceruloplasminu se průběžně sledovaly (kvůli riziku vytvoření anémie, protože ceruloplasmin se podílí i na transportu železa).
Redukce mědi ale má pouze pomocný vliv v léčbě nemoci. Klinická studie u glioblastomu NCT00003751 nepřinesla výsledky (Brem, 2005).
Pro praktické využití výše uvedeného lze použít menší dávky kyseliny alpha lipoové (ALA; odhadem 400mg obden) a vyřadit ze stravy potraviny s vysokým obsahem mědi. A samozřejmě případně multi minerálové doplňky stravy, které by mohly obsahovat měď. Použití ALA je třeba zvážit během chemoterapie a hlavně během radioterapie, neboť ALA má ochranný účinek proti záření, což může ochránit zdravé buňky, ale teoreticky i nádorové.
Disulfiram
Protinádorový účinek disulfiramu je závislý na mědi (podrobně viz článek o disulfiramu). Temozolomid + disulfiram u glioblastomu (Lun, 2016).
Disulfiram je také inhibitorem MGMT (Paranjpe, 2014). MGMT vytváří enzymy, které jsou schopny opravovat DNA poškození. Aktivita MGMT vede k rezistenci vůči léčbě temozolomidem. Potlačení MGMT znamená omezení schopnosti pro nádorové buňky se bránit poškození DNA (samy nejsou schopny si DNA opravovat).
Methylovaný vs nemethylovaný gen MGMT link. Úloha disulfiramu v zamezení rezistence na temozolomid (Triscott, 2012). Kromě toho je disulfiram i inhibitorem NF-kB.
Inhibice MGMT by měla zvýšit účinnost chemoterapie (Rood, 2004).
- lze s onkologem konzultovat přidání nízkodávkového disulfiramu k léčbě MEMMAT (nízkodávkový po vzoru low dose naltrexon terapie, kde se používá zhruba 1/10 doporučené denní dávky), nicméně jde o čistě experimentální možnost, která dává větší smysl v průběhu první fáze léčby k chemoterapii obsahující temozolomid.
EGCG + quercetin
Pilorget, 2003 pokus ve zkumace. EGCG byl účinný proti DAOY buňkám meduloblastomu. Dalším účinkem je inhibice telomerázy (Didiano, 2003). EGCG u mozkových tumorů (Yokoyama, 2001). V kombinaci s quercetinem by mohl mít vliv na redukci kmenových buněk u MB (Tang, 2010).
Quercetin zvyšuje citlivost MB buněk vůči ozařování (Hulleman, 2016). Labbé, 2006 ověřil fungování quercetinu v pokus ve zkumavce.
EGCG protokol by mohl být prospěšný, ale nemá u meduloblastomu výraznější výzkumné pokrytí, jako třeba kurkumin. Nicméně, EGCG protokol blokuje Wnt signalizaci, enzym telomeráza, snižuje expresi Bcl-2 a má vliv na blokaci angiogeneze. Tyto účinky jsou u léčby MB pozitivní. Quercetin se zdá velmi vhodným doplňkem během ozařování, tento efekt byl zjištěn napříč rakovinami (Lin, 2012).
Sulphoraphane
Viz také samostatný článek na webu. Gingras, 2003 zjistil, že DAOY nádorová linie meduloblastomu je velmi citlivá vůči vystavení sulphoraphanu. DAOY se používá jako model metastazujícího MB.
- lze doporučit přidat do stravy brokolicové klíčky jako doplněk k léčbě, i kvůli pozitivnímu vlivu sulphoraphanu na inhibici NF-kB a silnou HDAC inhibiční schopnost. Vysoké dávky sulphoraphanu ve formě doplňku by se musely pečlivě zvážit zvláště během chemoterapie kvůli vlivu na Nrf2. U MEMATu by ale neměl být problém v souběhu, neboť léky působí specifickým směrem (inhibice angiogeneze). Nicméně, i tady bych použil k sulphoraphanu pro vyvažovací účinek na Nrf2 luteolin, neboť Nrf2 může nepřímo ovlivňovat i angiogenezi např. Ji, 2014; Zhou, 2012
Resveratrol
Wang, 2003 vyvolal apoptózu skrze FAS dráhu.
Potlačení STAT3 (Yu, 2008; Wen, 2011). Autoři docházejí k závěru, že účinek resveratrolu na buňky meduloblastomu by měl být zvýšen použitím inhibitorů NF-kB (eliminuje se ochranný vliv exprese Bcl-2). Inhibitory NF-kB jsou kurkumin, genistein, sulphoraphane, AKBA, luteolin/apigenin, disulfiram aj.
- kombinovat resveratrol s inhibitory NF-kB a Bcl-2
Nejasná je úloha u SIRT-1. Pozitivní by měla být inhibice (Ma, 2013). Resveratrol by měl regulovat expresi SIRT-1 (Ma, 2013). Některé zdroje ale uvádějí, že je aktivátorem (wiki; Borra, 2005).
Patties, 2014 zjistil, že nádorové buňky meduloblastomu mají, pokud jsou po ozařování vystaveny resveratrolu, nižší schopnost přežití (přežívaly 2 až 900x méně, výsledky se různily podle nádorové linie).
- resveratrol jako vhodný doplněk po léčbě ozařováním (sníží schopnost přežití u přeživších nádorových buněk)
Důležitá může být schopnost resveratrolu regulovat c-MYC (Zhang, 2006). Inhibice c-MYC může být vhodná u pacientů s mozkovými tumory, které mají vysokou expresi (Swartling, 2012). U meduloblastomu (Bruggers, 1998; Herms, 2000). Role c-MYC u MB Raabe, 2010. Je třeba ale posoudit vliv na účinnost chemoterapie Bueren, 2011 kde naopak zvýšená exprese c-MYC byla v pokusu ve zkumavce korelována se zvýšenou citlivostí na chemoterapii.
Shu, 2010 zjistili protinádorovou aktivitu u bioaktivní formy trans-resveratrolu, v porovnání s neaktivní cis-resveratrol.
Bajula považuje protinádorovou aktivitu resveratrolu proti MB buňkám za výsledek snížení aktivity REST. Snížené hladiny REST v nádorových buňkách vedly ke zvýšení apoptózy. Mnoho variant MB má vysokou expresi RESTu (Fuller, 2005).
Rao, 2003 zjistil zvýšenou tumorogenicitu u myší u kombice aktivní SHH + c-MYC. Resveratrol je inhibitorem SHH (Huang, 2013).
Resveratrol bych doporučil před a po léčbě. Souběh s léčbou je třeba vyhodnotit zvlášť podle vybraných léčebných látek a dle varianty MB.
Kurkumin
Elamin, 2010 zkoumal kurkumin u nádorových buněk MB a zjistil, že downreguluje většinu z proteinů, jejichž snížení je u léčby MB prospěšné. Konkrétně inhibice Shh proteinů, a redukce aktivity v NF-kB a beta-catenin dráze, což způsobilo sníženou expresi C-myc, N-myc a cyclinD1. Potlačení Wnt/β-catenin signalizace (He, 2014). Hu, 2014 kurkumin inhibuje Wnt/β-catenin signalizaci.
Pozitivním účinkem je také schopnost inhibovat HDAC (Lee, 2011; Azad, 2014). Kurkumin je schopen se dostat do mozku přes mozkovou bariéru. V pokusu na myších měly ty, kterým byl podáván kurkumin, mnohem delší přežití u MB.
Ecker, 2015 doporučuje HDAC inhibici u Group 3 varianty MB s amplifikací MYC.
Postup nádoru je podporován proteiny Bcl-2 a MMP-9, které jsou oba regulovány NF-kB. Vhodné je tedy nasazení NF-kB inhibitorů (např. kurkumin; Kansra, 2010).
Melnick, 2012 zjistil synergii kurkuminu s etoposidem a temozolomidem. Je tedy vhodným doplňkem pro MEMMAT, kde jsou obě látky.
Kurkumin také dokáže inhibovat telomerázu u nádorových buněk v mozku (Khaw, 2013).
Článek o roli kurkuminu u mozkových nádorů Nelson, 2012.
Kurkumin se jeví jako optimální doplněk při léčbě meduloblastomu s velmi širokým působením. Podrobně o kurkuminu v samostatném článku na tomto webu.
Perillyl alcohol
Perillyl alcohol (dále jen “PA”) je látka, která se nachází v esenciálních olejích z různých rostlin jako např. máty (peprné a klasnaté), levandule, šalvěje, citrónové trávy aj. Dá se ale získat i z citrusů, pomerančů, višní, brusinek, semínek celeru aj. PA vzniká z limonenu, což je látka, která se uvolňuje např. z kůry citrónů a pomerančů a dává kůře charakteristickou vůni.
V léčbě rakovin se nejprve PA zkoušel podávat ústně, ale výzkum nepřinesl žádné zajímavé výsledky. Obrat přinesly až pokusy s nosní inhalací látky. A velmi zajímavých výsledků bylo dosaženo zejména u mozkových nádorů. U inhalace byla navíc potvrzena bezpečnost a vykazuje jen velmi nízkou hladinu toxicity.
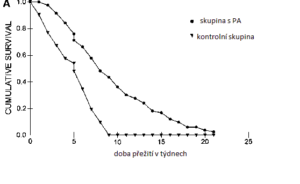 Fonseca, 2011 zkoušel PA ve studii u 89 dospělých pacientů s glioblastem u nichž došlo k návratu onemocnění (relapsu). Výsledky léčby porovnal s tím, jak si v době studie vedli pacienti ve statistikách běžné léčby (do této skupiny vybral pro sledování 52 pacientů, kteří měli obdobnou diagnózu/prognózu). Pacienti v PA skupině inhalovali 440mg PA denně.
Fonseca, 2011 zkoušel PA ve studii u 89 dospělých pacientů s glioblastem u nichž došlo k návratu onemocnění (relapsu). Výsledky léčby porovnal s tím, jak si v době studie vedli pacienti ve statistikách běžné léčby (do této skupiny vybral pro sledování 52 pacientů, kteří měli obdobnou diagnózu/prognózu). Pacienti v PA skupině inhalovali 440mg PA denně.
V porovnání bylo u PA skupiny zjištěno delší přežití, téměř bez jakýchkoliv vedlejších účinků léčby. Navíc delší přežití vykazovali i pacienti s nádory hluboko v mozku, v těžce dostupných oblastech.
Fonseca, 2015 podrobně popisuje případ ženy, která kombinovala léčbu temozolomidem a PA a u níž došlo k zastavení postupu nemoci po dobu delší 24 měsíců.
Fonseca. 2011 je případová studie ženy s relapsem pokročilého glioblastomu, která dosáhla více než 5 letého přežití. Užívala jako léčbu pouze PA 4x denně celkem 268mg/den a došlo u ní k zastavení postupu nemoci a později ke zmenšení nádoru, které potvrdil mozkový scan po 3 a 5 letech.
Fonseca, 2008 klinická studie fáze I/II; 37 pacientů (29 s glioblastomem, 5 s astrocytomem a 3 s oligodendrogliomem). U 2 pacientů došlo ke zmenšení nádoru o více než 50%. U 19 pacientů došlo ke stabilizování nemoci (na CT/MR nebyla žádná změna velikosti, ani nový nález). Nebyly zaznamenány žádné nežádoucí vedlejší účinky.
Fonseca, 2013 sledovali pacienty z předchozích studií. Je důležité zmínit, že šlo o pacienty, kteří již vyčerpali léčebné možnosti a procházeli pouze paliativní léčbou. Ještě celých 19% z těch, kteří po celou dobu užívali jako jedinou léčebnou terapii PA, bylo po 4 letech stále naživu a v klinické remisi. U mozkových nádorů, které se již léčí pouze paliativně, je tak vysoké procento dlouhodobého přežití zcela výjimečné. Vždyť pacienti s glioblastomem se v průměru dožívají jen 12 měsíců a méně než 10% jich přežívá 5 let (a to včetně těch, u kterých byla úspěšná hned první léčba; kdežto ve studii s PA jde o pacienty u kterých léčba selhala a nemoc postupovala dále).
Stručný přehled použití nosního spreje s perillyl alcoholem u nádorů mozku viz článek. Další teoretické shrnutí Chen, 2015.
PA také může zvýšit citlivost u chemoterapie a radioterapie (Rajesh, 2003).
NEO212 je lék procházející klinickým testováním, který spojuje temozolomid s perilly alcoholem a testuje se u nádorů mozku, které jsou rezistentní na temozolomid. Ve výzkumu na myších Chen, 2015 byla kombinace účinná i v případech trojitě negativního karcinomu prsu, který je odolný vůči léčbě temozolomidem samostatně. PA se zkouší i v kombinaci s lékem rolipram jako NEO214.
Letos byla zahájena klinická studie léku NEO100 (NCT02704858) u pacientů s relapsem glioblastomu grade 4. Lék (vysoce čistý PA) vyvíjí firma NEONC.
Závěrem se dá konstatovat, že PA je levný a bezpečný doplněk léčby, jehož podávání nevykazuje žádné vedlejší účinky a může potenciálně zlepšit vyhlídky pacientů. Pro více informací viz samostatný článek na tomto webu.
Další náměty
- DHA/EPA protinádorový účinek u MB (Ljungblad, 2014; pokus ve zkumavce). Ljungblad, 2015 zaznamenala účinek i v pokusu na myších. DHA/EPA mělo příznivý ochranný vliv na zdravé buňky a protinádorovou aktivitu u nádorových buněk. Role DHA/EPA je ale u rakovin nejasná.
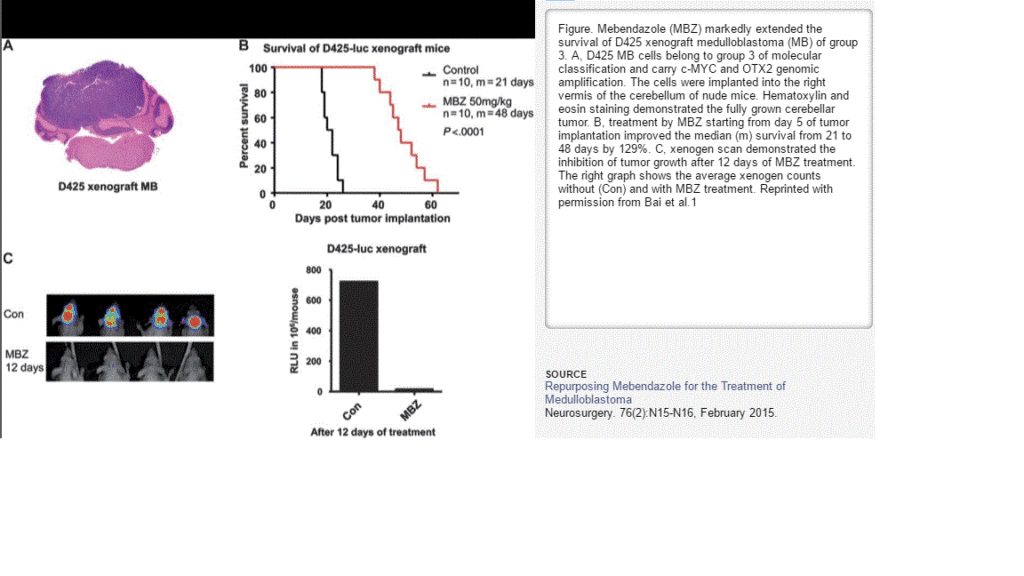
- mebendazole (proti parazitický lék; u nás jako Vermox) jako blokátor angiogeneze u MB, VEGF a VEGFR2a inhibitor a též hedgehog inhibitor Larsen, 2015 (Bai, 2014 a 2015; Bodhinayake, 2015 studie u myší viz obrázek níže; v klinické studii fáze 1 u MB NCT02644291). Z protiparazitických léků se ještě v klinické studii zkouší nifurtimox (NCT00601003 spolu s cyclophosphamidem a topotecanem). Podrobněji v samostatném článku na tomto webu.
- thymoquinone (Ashour, 2016) jako inhibitor NF-kB zastavil v pokusu ve zkumavce růst buněk MB; TMQ je navíc vhodným doplňkem během ozařování. Olej ze semen černuchy seté má také účinek proti cytomegaloviru. Vzhledem k ochrannému účinku TMQ na játra a ledviny lze olej přidat k léčbě.
- vitamín D3. Doporučení doplňovat vysoké dávky D3 platí u rakovin téměř univerzálně, nicméně nejprůkaznější je použití u kolorektálního karcinomu. U MB by pomohl pomáhat při inhibici Shh (Hadden, 2013; Maschinot, 2015).
- selen. U dětských pacientů s rakovinou byly zjištěny nižší hladiny selenu než u zdravých dětí (Karaman, 2014). Vhodné formy selenu v doplňcích jsou uvedeny v článku na tomto webu.
Určité preklinické výsledky má i aplikace léku na migrénu Clotam. Viz např. Eslin, 2013; Jones, 2015; Eslin, 2015. Jde o lék z kategorie NSAID (COX inhibitor).
Relaps meduloblastomu
Je třeba vzít v úvahu, že u pacienta, který podstoupil léčbu a u něhož se nemoc vrátila, se již nemusí jednat o stejným typ MB jaký byl identifikován při diagnostice před léčbou. Toto téma podrobněji zkoumá Morissy, 2016.
Na základě rozborů a porovnání vzorků od lidí i myší, provedených před první léčbou a po relapsu, došli k výsledku, že jen u méně než 12% vzorků byly stále přítomny stejné mutace, které byly diagnostikovány na začátku.
Autoři zde vidí možný hlavní důvod selhání cílených terapií v léčbě relapsu u MB, z toho důvodu, že se vychází z cíle, který byl určen na začátku, nicméně vlivem léčby se u přeživších nádorových buněk mohly vyvinout nové charakteristiky a cíle se změnit (článek).
Terapeutické cíle u Group 4
- G4 je charakteristická nízkou expresí Myc a N-Myc. Amplifikace N-Myc je vzácná. Nicméně, inhibitory N-Myc mohou stále být vhodným doplňkem léčby, nicméně budou mít zřejmě menší důležitost (Roussel, 2013)
- aktivní onkogeny GFI1/GFI1B (Northcott, 2014) – vhodný zásah je tedy inhibice obou genů nebo proteinů, které produkují nebo následných procesů. GFI1 významně ovlivňuje STAT3 (Tavassoli, 2000) a tím pomáhá nádoru. Vhodné jsou zde HDAC inhibitory (Wang, 2013; Furchert, 2007; Milde, 2010). Terapeutické cíle pro inhibici jsou HDAC5 a HDAC9. U G4 jde obzvláště o HDAC5. V klinickém testování běží HDAC inhibitory třídy IIA, které zahrnují HDAC 4, 5, 7 a 9 (Bass, 2013). Jde např. o lék LMK 235 (Marek, 2013; zřejmě ještě v preklinickém výzkumu) a Givinostat (ITF2357), který by již teoreticky mohl být k dispozici.
- důležitým cílem je aktivita enzymů histondeacetylázy (HDAC)
HDAC inhibitory (Rajendran, 2011) jsou kurkumin, sulphoraphane (nejlepší produkt je asi tento BroccoMax, který obsahuje sulphoraphane a enzym myrosináza, který je nezbytný pro jeho účinek), quercetin, EGCG, I3C, genistein a luteolin (Attoub, 2011). Luteolin nejlépe zřejmě z UK od Swansonu. Další možností je sodium butyrate, ale není to zcela běžné jako doplněk stravy, našel jsem na Amazonu. U MB se zkoušel ve studiích ve zkumavce (Nor, 2013 kmenové buňky MB; Nor, 2011). Nicméně, bude bezpečnější zůstat u prověřených látek. Nepodařilo se mi najít dostupný přírodní HDAC inhibitor, který by specificky inhiboval HDAC5.
Složky potravy, které vykazují anti-HDAC aktivitu: seznam potravin v Bassett, 2014. Jde např. o česnek (allicin), zelený čaj (EGCG), skořici a zázvor. Z koření bazalka (jako zdroj kyseliny ursolové, tedy i jablečné slupky). Ze zeleniny hlavně brukvovitá, obzvláště brokolice. Další informace: shrnutí výzkumů HDAC v práci Mottamal, 2015
- CDK6 (protein kináza; gen CDK6 bývá amplifikován; negativně reguluje tumor supressor RB; u MB je CDK6 up-regulován, cílem je tedy down-regulace).
CDK6 inhibitorem je Palbociclib (lék na trhu pod názvem Ibrance), který je ale zatím schválen pouze pro rakovinu prsu. U meduloblastomu (Whitetaker, 2013) je zatím v běhu pouze v klinické studii fáze I u mozkových tumorů (NCT02255461).
Přírodním inhibitorem CDK6 je fisetin (Sung, 2007; Lu, 2005), kromě toho down-reguluje MMP-9 (důležitý faktor u MB) a VEGF (tedy působí proti angiogenezi) a down-reguluje také NF-kB. Swanson Ultra Fisetin nebo Doctor´s Best obojí má 100mg fisetinu a 30 kapslí.
- KDM6A mutace nejčastější v Group 4 (Dubuc, 2013)
- EZH2 je enzym, který pokud je produkován nadměrně (jako v případě MB G4; Rajeev, 2014; Robinson, 2012), tak působí jako vypínač tumor supresivních genů. U meduloblastomu potlačuje např. aktivitu tumor supresoru DAB2IP, jehož přítomnost koreluje s dobrou prognózou (Smits, 2012). Downregulace EZH2 by také mohla mít přímý vliv na zpomalení šíření nádoru (Alimova, 2012; 2013). EZH2 se podílí také na aktivaci c-myc a cyclinD1. Použití inhibitoru EZH2 může zvýšit účinek etoposidu. EZH2 je také vybraným cílem imunoterapeutického výzkumu onkolytického viru u MB (Ricke, 2015).
EZH2 inhibitorem je látka tanshindiol (Woo, 2014) z rostliny Danshen (Salvia miltiorrhiza; šalvěj červenokořenná). Článek o bylině na examine.com. Užívá se Fufang Danshen Dripping pills nebo tablety (tradiční lék z TCM, prodává se i u nás). CyclinD1 aktivity potlačuje užití mTor inhibitorů, HDAC inhibitorů a CDK inhibitorů např. CDK 4/6 (Sangar, 2013). Volkel, 2015 se zabývá inhibitory EZH2 a z přírodních látek zmiňuje EGCG (Eckert, 2011) a kurkumin (Hua, 2010). Možnost omega-3 ve specifické var. polynenasycené (Dimri, 2010) by se musela hlouběji prozkoumat.
- OTX2 (Adamson, 2010; Kaur, 2015) u MB amplifikován a overexpresován a působí jako onkogen. Vyskytuje se specificky u G3 a G4, nikoliv u Shh a Wnt (resp. u těchto nepůsobí onkogenně). OTX2 upreguluje Myc.
Potlačení OTX2 pomocí kyseliny retinové, oxidované formy vitamínu A (retinoic acid; Bai, 2010). Tato léčba je někdy přidávána jako bioterapie lékem Roaccutane, k chemoterapii. Mohlo by jít o zajímavý doplněk k MEMMAT, který by byl přesně na míru pro pacientu z Group 4. Je zajímavé, že OTX2 potlačuje GABAergic diferenciaci (Puelles, 2006) a tím zřejmě upřednostňuje glutamatergic cestu, čímž je OTX2 proteinová over-exprese u G4 prospěšná pro nádor – škodlivá pro pacienta.
Pracovní poznámky k tématu role glutamátu u G4; glutamátové receptory, glutamátové transportéry
G4 je glutamatergic tumor (pro svůj růst využívá glutamát a jeho zvýšeným vylučováním z nádorových buněk také přetváří okolí; vysoké koncentrace glutamátu v okolí nádorové buňky působí na ostatní zdravé buňky toxicky). Wilson, 2014 zjistil, že vysoké hladiny glutamátu korelovaly s kratším přežitím dětských pacientů s MB. Inhibitory glutamátu u nádorových buněk (rakovina prsu; Fazzari, 2015; článek).
- mGluRs receptory. mGluR1 a mGluR4-6 jsou overexpressed u MB (Teh, 2012). Nicméně Iacovelli, 2006 dochází k závěru, že farmakologická aktivace mGLU4 vedla k zastavení růstu nádoru u MB (podrobně i v Melchiorri, 2007; neplatí to např. pro varianty tumoru, který nemá tento recept aktivní). Týká se toto ale varianty G4, která je závislá na glutamátu? Aktivace mGLU4 totiž může u jednotlivých variant mít úplně rozdílné výsledky, protože např. Group 3 je charakterizována jako GABAergická, což je v podstatě opak glutamatergické atp. Cílení indukční nebo inhibiční na glutamátové receptory neumím vyhodnotit. Např. jestli může být prospěšná suplementace GABA (Birnir; Ortega, 2003) či zinku?
- glutamát transportér inhibitory
L-Theanine je látka obsažená v zeleném čaji. Je glutamátovým analogem, který s glutamátem soupeří o vazbu na glutamátový receptor. Je také inhibitorem glutamátových transportérů a zvyšuje GABA. L-Theanine u rakovin (Liu, 2009). Zvyšuje také účinnost chemoterapie u látek, které se vážou na glutamátové receptory (MSK; např. doxorubicin); nádorová buňce snižují možnost lék vyplivnout ven (efflux). Kromě zvýšení účinnosti ale paradoxně došlo i ke snížení nežádoucích vedlejších účinků doxorubicinu. U nádorové buňky totiž se připojí na glutamát receptor a sníží efflux, u zdravé buňky se ale po připojení na glutamát receptor metabolizuje na glutamát (Sadzuka, 2004). Pokud by tento odlišný mechanismus platil, mohl by být L-Theanin vhodným doplňkem k léčbě u G4. Nejlepší produkt je od Swansonu Ultra Double Potency Suntheanine L-Theanine 200mg / 60 veg. kapslí.
- taurin (Bulley, 2010; článek; Trenkner, 1999; Louzada, 2004); taurin by mohl mít balanční účinek a snižovat glutamátovou toxicitu vytvářenou nádorovými buňkami, ale nejsem schopen toto téma vyhodnotit.
Terapeutické cíle pro Shh skupinu
Toto je pouze krátký výběr, téma ještě nemám zpracováno. Hotová je pouze G4 (viz výše). u Shh je třeba se zaměřit na inhibici Shh a N-Myc.
- BRD4 inhibitory by mohly být účinné u Shh a Group 3 Myc-driven (Vibhakar, 2014). Naopak nejspíše nepůsobí na G4.
- N-Myc amplifikace. Amplifikované kopie onkogenů mutovány nejsou, vytváří normální protein, ale v buňce je v důsledku amplifikace nadměrné množství proteinu. Nadměrná aktivita N-Myc je spojena s tumorogenezí. Amplifikovaný N-Myc koreluje se špatnou prognózou u nádorů mozku.
- Inhibitorem N-Mycu je fucoxanthin (Okuzumi, 1990) z hnědé mořské řasy. Fucoxanthin inhibuje i MMP-9 (Chung, 2013). K dostání je látka z hnědé řasy fucoidan (Dickinson, 2015) od Life Extension standardizovaný extrakt 75mg / 60 kapslí (z UK). Lepší je možná Doctor´s Best (nebo z UK), také std. extrakt 210mg v kapsli / 60 kapslí. A extrakt z řasy od Swansonu. Přímo fucoxanthin má Vitacost 50mg, ale jde o extrakt, nejspíše nikoliv o čistý obsah fucoxanthinu (vzhledem k ceně a v porovnání s ostatními produkty, které mají většinou 5mg). U ostatních produktů buď není znám přesný obsah, nebo není obsah standardizován.
Bude lépe fucoxanthin (karatenoid), neboť u fucoidanu (sulfated polysacharid) jsem nedohledal výzkum ohledně vlivu na N-Myc. Nejlepší tak může být na Amazonu Solaray Fucoxanthin 30 kapslí 2mg fucoxanthinu, 170mg fucoidanu. Či spíše BRI Nutrition 60 kapslí / 5mg fucoxanthinu. Stejný produkt má I3.
U obou látek je potřeba prozkoumat jejich vliv na blokaci LDH-A, která může být u nádorů mozku velmi důležitá.
Pro regulaci N-Mycu by měly být vhodné je i PI3K/mTOR inhibitory (Beltran, 2014). PI3K inhibitory jsou také vhodné do kombinace s HDAC inhibitory.
- PI3K inhibitory: neoalbaconol, wogonin (z šišáku bajkalského), plumbagin, quercetin, resveratrol, kurkumin
- mTOR inhibitory: EGCG, kurkumin, resveratrol, kofein, apigenin, quercetin, resveratrol
MEMMAT – složení léčebného protokolu a návrhy synergických látek
Bevacizumab (Avastin). Inhibitor angiogeneze na bázi VEGF. Spolu s kurkuminem (Gao, 2015). Jde o nejlepší kombinaci, která se také testuje v klinické studii. Komplementární by mohlo být ještě i EGCG, které také down-reguluje VEGF (Romo-Garcia, 2010). Další přírodní inhibitory VEGF viz tabulka.
Velmi dlouhý half-life (20 dní). Je třeba dávat pozor na zvýšení krevního tlaku a také způsobuje zhoršenou hojivost ran. Podrobně zde.
Interakce s jinými léky zde. U souběhu s thalidomidem je zvýšené riziko krevních sraženin (odkaz).
U Avastinu je častějším nežádoucím účinkem zvýšení krevního tlaku. Pozitivní vliv na snížení krevnímu tlaku by měla mít suplementace česneku (allicin; nejlépe ve formě aged-garlic).
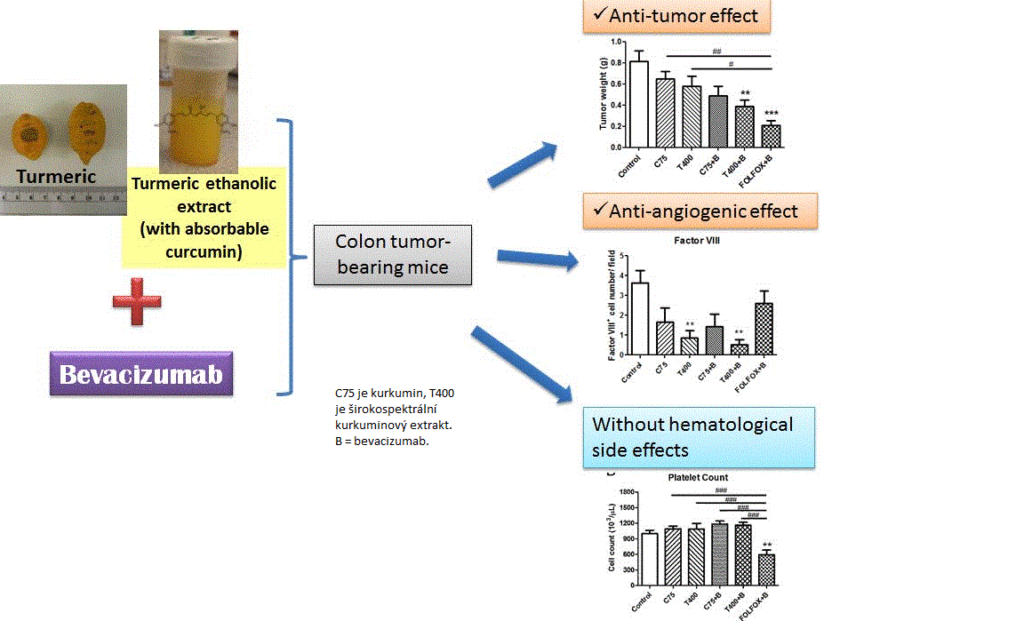
Yue, 2016 ilustruje výrazný benefit spojení Avastinu a kurkuminu u nádoru tlustého střeva u myší. T400 je ethanolový extrakt kurkumy. C75 je kurkuminový extrakt (byl podáván v dávce 75mg na kilo váhy). Výsledky u C75 i T400 jsou navíc negativně poznamenány tím, že autoři nepoužili ke kurkuminu látky, které zvyšují jeho biodostupnost (např. piperin). Myslím si, že i tak dobré výsledky by mohly být ještě daleko lepší, neboť piperin zvyšuje biodostupnost zhruba 20x. V podrobných výsledcích se dá dohledat i výsledek Avastinu samostatně na růst nádoru, který ale paradoxně nebyl statisticky signifikantní oproti kontrolní skupině bez léčby, narozdíl od kombinace Avastinu a obou kurkuminových variant. FOLFOX je hlavním léčebných programem u kolorektálního karcinomu (oxaliplatina, 5-fu a leucovorin).
Thalidomid. Je třeba dávat pozor na pokles bílých a červených krvinek. Působí také jako inhibitor angiogeneze a používá se zejména v léčbě myelomu.
Metabolismus viz link. Half-life 5-7 hodin.
Celecoxib je inhibitorem COX-2 viz kapitola o cytomegaloviru. Je třeba dávat pozor na souběh s látkami, které ovlivňují CYP2C9. Z látek v alternativní medicíně jde např. o quercetin. Mohl by mít synergii s kurkuminem (Dandekar, 2014). Shirode, 2010 našli synergii mezi celecoxibem a nízkými dávkami gamma tocotrienolu. Nejsilnější protirakovinový účinek má ale delta-tocotrienol. Zde by stálo za úvahu nasazení nízkých dávek k celecoxibu. Nejlepší produkt na trhu je Nutricology kde je 90% delta a 10% gamma. I tady bude zřejmě vhodný luteolin (Jeon, 2015). Vhodné je také EGCG (Fujiki, 2006; Huang, 2012).
Info k metabolismu. Po 5 dnech užívání už se vytvoří v krvi konstantní hladiny. Je metabolizován CYP2C9 (a v menší míře 3A4). A je inhibitorem CYP2D6. U CYP2C9 je třeba dát pozor na vysoké dávky quercetinu, které blokují tento enzym. Platí, že čím vyšší aktivita CYP2C9, tím menší koncentrace aktivního léku v krvi. Někteří lidé mají tzv. genetický polymorfismus u genu pro tento enzym, a vytváří se jim enzymů málo. U nich je pak třeba zvolit nižší dávkování, neboť se jim v krvi objevují mnohem vyšší koncentrace aktivného léku (v játrech je málo enzymů, které by je metabolizovaly na léčebně neaktivní sloučeniny).
Fenofibrat. U rakovin působí jako down-regulátor VEGF, VEGFR a HIF-1α
Etoposid. Vhodným doplňkem je kurkumin (Melnick, 2012; výzkum ve zkumavce na buňkách mozkových nádorů). Saleh, 2012 ale zjistil protikladné působení mezi Etoposidem a kurkuminem, zkoumal ale působení u nádorových linií rakoviny prsu, jater a trávící soustavy. Dilema by mělo jít vyřešit použitím kurkuminu s dostatečným časovým předstihem před Etoposidem (6 hodin a více). V takovém případě by měl kurkumin působit chemosenzitivizujícím účinkem.
Etoposid je vhodné spojit s inhibitory EZH2 (viz výše) a HDAC inhibicí.
Další náměty: s malými dávkami resveratrolu (Vefa, 2013). Určitý pozitivní účinek by mohlo mít i užití melatoninu večer den před dávkou etoposidu (Lissoni, 1997; klinická studie cisplatina+etoposide s nebo bez melatoninu). Další možností je kombinace se silibininem (Soliman, 2015; Kane, 2013).
Informace o působení etoposidu u MB Ivanov, 2015. Model ukazuje, že hlavní problém je vysoké procento přeživších kmenových buněk (40%), kdežto běžných přežilo jen 6,5%.
Tématem kmenových buněk MB (BTICs) se zabývá Singh, 2012; 2013. Experimentální stimulací miR-135a pro potlačení kmenových buněk se zabýval Galli, 2015. Zjistili, že vynucená up-regulace miR-135a vedla k zablokování tumorogeneze. Hong, 2015 se zabývá přírodními látkami, které ovlivňují miR-135a. Např. jmelí způsobuje down-regulaci, u MB by tedy mělo být nevhodné. Aktivace miR-23a je vhodná pro účinek etoposidu (Wang, 2013). V této oblasti by podle Hong, 2015 měl působit berberin (doporučen níže pro kombinování s melatoninem, kdy kombinace vykazuje synergický efekt u inhibice telomerázy).
Cyclophosphamid. Působí synergicky s kurkuminem (výzkum u rakoviny psů; Gurel, 2014). Nicméně pokus ve zkumavce zjistil při souběhu sníženou apoptózu (Orlowski, 2002). Komplexněji na toto téma na podkladě dostupných studií West, 2014. Bude vhodné kurkumin oddělit od cyclophosphamidu alespoň 6 hodinovým odstupem. A s již doporučeným CDK6 inhibitorem fisetinem (Touil).
Liposomal cytarabin. Kurkumin zvyšuje citlivost nádorových buněk vůči léčbě (Rawal, 2015). Podobně funguje u etoposidu zmíněný silibinin (Desai, 2015). Účinek zvyšuje použití inhibitorů HDAC.
Vybrané doplňky k léčbě MEMMAT u G4 MB
Z výše uvedeného bych k MEMMATu doporučil jako hlavní doplňky k léčbě tyto látky (dávkování se stanoví individuálně; přikládám i odkazy na produkty, které považuji za nejlepší):
- kurkumin + piperin (širokospektrální extrakt obsahující turmerony Life Extension; nebo to samé z UK; a standardní 700mg kurkumin+piperin Swanson; alternativou je 300mg, ale navic 300mg berberinu). Možné další synergické látky ke kurkuminu viz Halifax protokol. Podrobný článek o kurkuminu.
- EGCG s malou dávkou kapsaicinu a quercetinu (quercetin vzhledem k potenciálnímu ovlivnění celecoxibu jen v malém množství; produkty s EGCG viz Halifax EGCG protokol)
- fisetin (Swanson Ultra Fisetin nebo Doctor´s Best obojí má 100mg fisetinu a 30 kapslí.)
- silibinin (Swanson Ultra Standardised Siliphos. Širokospektrální Jarrow.)
- luteolin (Swansonu)
- sulphoraphane (BroccoMax)
- melatonin (užíval by se pouze večer v den před plánovanou dávkou etoposidu) + berberin (inhibice telomerázy, aktivace miR-23a)
- reishi
- 5-Loxin (extrakt AKBA kyseliny boswellové, který má výraznější účinek než aspirin při inhibici COX-2 Wang, 2014). AKBA inhibuje i MMP-9 a VEGF.
Z více experimentálních věcí se mi zamlouvá suplementace gamma/delta tocotrienolů Nutricology (delta a gamma tocotrienol jsou potentními inhibitory VEGF např. Shibata, 2009; zajímavá je i studie Hiura, 2009 o specifické akumulaci v nádorových buňkách; Lim, 2014; deaktivace STAT3 Rajendran, 2011; starší shrnutí Aggarwal, 2010; novější shrnutí Ahsan, 2014).
A produkt od Enzymatic, který by bylo dobré užívat před spaním. Obsahuje honokiol (extrakt z magnólie, který je v textu několikrát zmíněn), L-Theanine (zmíněn jako inhibitor glutamátových transportérů) a withania somnifera extrakt, který je u rakovin také vhodný, zároveň jde o relaxant a adaptogen (pozitivní vliv na náladu).
Vhodný by byl EZH2 inhibitor, neboť jde u MB G3 a G4 o jeden z nejdůležitějších cílů a navíc může zlepšit účinnost etoposidu. U nás zřejmě není k dispozici inhibitor EZH2 pro užití v onkologii, látky jsou zatím pouze v testování (Tazemetostat EPZ-6438 ve fázi I; další jsou ještě stále v preklinickém výzkumu Campbell, 2015). Tedy vlastně ikdyž víme, že jde o důležitý cíl, tak zatím nemáme k dispozici prostředky jak ho ovlivnit. Výše jsem zmínil Danshen, ale dal bych přednost látkám, které již jsou doporučeny a kupodivu mohou mít účinek i v této oblasti: EGCG (Eckert, 2011) a kurkumin (Hua, 2010). Možnost omega-3 ve specifické var. polynenasycené (Dimri, 2010) by se musela hlouběji prozkoumat.
Vhodná strava by měla být zejména bohatá na zeleninu (obzvláště brukvovitou a celer jako zdroj luteolinu a apigeninu). A potraviny, které vykazují HDAC inhibiční aktivitu a anti-angiogenní aktivitu (viz např. seznam; VEGF inhibice; přednáška z TEDu o potravinách, které napomáhají inhibici angiogeneze).
Vhodný je typ středomořské kuchyně, kde se hodně používají bazalka a oregáno. Více o přírodních inhibitorech angiogeneze v článku o Halifax studii. Je tam graf, který porovnává účinek na angiogenezi a ve kterém je i celecoxib a kupodivu je v síle účinku až ve spodní části tabulky.
Z bylin je vhodné vařit s těmi, které prokazují inhibiční aktivitu na COX-2 (článek).
Z látek, které se dají získat z čajů, je první volbou lapacho (lapachol) a na druhém místě pak heřmánkový čaj (apigenin) a šalvějový.
Zásadní je zhodnotit možnou roli léku proti HCMV a perillyl alcoholu pro nosní inhalaci. Dalším námětem je doplnění MEMMATu o Roaccutane, který se někdy podává během léčby v první etapě nemoci a který působí na důležitý cíl u G4 OTX2.
Také by se mělo zvážit nasazení mebendazolu, u něhož běží 2 klinické studie fáze I u dětí s MB (NCT02644291 a NCT01729260; a jedna u dětských gliomů NCT01837862) a který je snadno dostupný jako lék Vermox a má výborný bezpečnostní profil (lék běžně užívaný dětmi při infekci roupem s minimálními vedlejšími účinky). U MB funguje mebendazole jako inhibitor VEGF, VEGFR2a a Shh, tedy vše v duchu MEMMATu. Zřejmě působí také u c-Myc a OTX-2 amplifikace (pokus na myších v Bai, 2015).
De Witt, 2017 usuzují, že mebendazole má v léčbě MB daleko větší potenciál než vincristine.
Publikováno: 28.5.2016
Poslední aktualizace: 23.7. 2017
Autor: Patrik Schoupal