 Představte si, že jste se ocitli ve středověku a jste král, který táhne s armádou na hrad svého nepřítele. Hrad nepřítele je v této analogii nádorovou buňkou. Jak povedete útok? Zaútočíte z více stran najednou? Použijete katapulty s kameny na boření zdí a střely se zapáleným dehtem, které nadělají požáry uvnitř? Obléhací věže? Beranidla? Pokusíte se najít tajné podzemní cesty do hradu, kterými proudí v noci zásoby?
Představte si, že jste se ocitli ve středověku a jste král, který táhne s armádou na hrad svého nepřítele. Hrad nepřítele je v této analogii nádorovou buňkou. Jak povedete útok? Zaútočíte z více stran najednou? Použijete katapulty s kameny na boření zdí a střely se zapáleným dehtem, které nadělají požáry uvnitř? Obléhací věže? Beranidla? Pokusíte se najít tajné podzemní cesty do hradu, kterými proudí v noci zásoby?
Věřím, že pokud na hrad zaútočíme co nejvíce způsoby, máme největší šanci na vítězství. Bohužel v praxi onkologické léčby je problém bojovat více cestami současně, kvůli vysoké toxicitě léčby. Bylo by skvělé, kdybychom mohli použít najednou třeba 10 chemoterapeutických léků, každý s jiným mechanismem účinku a ještě u toho ozařovat. Rakovina by nepřežila. Ale bohužel by nepřežil ani pacient.
Existují ale účinné látky s nízkou toxicitou, které narušují celou řadu procesů, které rakoviny využívají a které, narozdíl od chemoterapie, můžeme nasadit ve velkém počtu. A chemoterapii si můžeme ponechat jako hlavní zbraň, jako mocné masivní beranidlo, kterým roztlučeme hlavní bránu.
Dobývání hradu
Budeme cílit na metabolické procesy rakovin, na způsoby jakými se rakoviny živí, např. tím, že jim znepříjemníme obstarávání glukózy a přeměnu glutaminu.
Mutace ovlivňující aktivitu genů při produkci proteinů můžeme utlumit nebo pokud to bude výhodné, stimulovat, pomocí látek s epigenetickým účinkem jako je kurkumin nebo genistein, které dokáží poopravit nefunkčnosti, které máme dány od narození v genech či změny v genové aktivitě, které si ku svému prospěchu zařídila a prosazuje rakovina.
Ochranný oblek nádorových buněk tvořený proteiny Hsp70, který je chrání před poškozením zvnějšku, můžeme narušit pomocí extraktu ze zeleného čaje, látky EGCG.
Pomocí karnosolu, který je v rozmarýnu, šalvěji a kurkuminu (hlavní účinné látky v kurkumě) omezíme rakovinám produkci enzymu Bcl-2, jehož produkcí se vyhýbají vlastní smrti.
Postaráme se o blahobyt našich vlastních vojáků – zabijáckých NK buněk a odvážných T-lymfocytů a pomocí betaglukanů zvýšíme jejich počty a jejich bojové odhodlání.
Můžeme využít nových léčebných cest v imunoterapii, které promění naše T-lymfocyty v rozzuřené vikingské válečníky, kterým se říkalo berserkové, kteří budou sekat hlava nehlava.
Prostě budeme nádorové buňky otravovat všemi možnými směry a dělat jim z života peklo. Až k vítězství.
Projekt Halifax
Tento článek přináší podrobný, komplexní návrh širokospektrálního útoku na hlavní životně důležité procesy rakovin, a to za pomoci látek s nízkou toxicitou.
Článek vychází z dat, která shromáždil Keith Block a publikoval v článku “Designing a broad-spectrum integrative approach for cancer prevention and treatment” (Návrh širokospektrálního přístupu v prevenci a léčbě rakovin) v časopise Seminars in Cancer Biology v roce 2015.
Do projektu se zapojilo 180 vědců z celého světa. Cílem projektu, který dostal název Halifax, bylo:
- identifikovat u rakovin nejzásadnější cíle pro léčebný zásah
- navrhnout látky s nízkou toxicitou, které by mohly mít v těchto oblastech pozitivní účinek a jejichž působení je nejvíce podloženo výzkumy.
Výstupem z projektu byla identifikace 74 cílů v 11 hlavních oblastech a návrh potenciálně účinných látek, které by v té které oblasti mohly být prospěšné a zlepšit vyhlídky pacienta na vyléčení.
Rozhodl jsem se závěry z Blockovy práce zpracovat do článku v češtině, protože se domnívám, že jde o článek zcela zásadní hodnoty, který obdivuhodným způsobem mapuje ty nejdůležitější oblasti možných léčebných zásahů proti rakovinám.
Více léků najednou
Článek přichází s ideou širokospektrálního léčebného zásahu, který považuji za budoucnost v léčbě rakovin. Takový přístup bude aplikovat mnoho různých účinných látek najednou, kde každá útočí ve stejnou chvíli na jiné slabé místo rakoviny. Takovýto přístup znemožňuje rakovinám se přizpůsobit a vyvinout si odolnost vůči léčbě, jak se běžně děje u chemoterapie a radioterapie, kde se aplikují většinou pouze jeden či dva chemoterapeutické léky současně (a to ještě s časovým odstupem), které ze začátku vykazují určitou úspěšnost, ale při dalších cyklech podávání jejich účinnost rapidně klesá s tím, jak se část nádorových buněk na mechanismus působení účinné látky v léku dokáže adaptovat. Kvůli vysoké toxicitě většiny chemoterapeutik je problém podávat současně 3 a více látek a děje se tak v praxi jen výjimečně (např. FOLFIRINOX protokol u rakoviny slinivky, kde se podávají 3 různé léky s jednou pomocnou látkou). Pro pacienty je ale taková léčba na hranici únosnosti kvůli vedlejším nežádoucím účinkům.
Cukráři netáhnou za jeden provaz
Bohužel velmi nízké zastoupení kombinovaných léčebných terapií u rakovin je dáno strukturou schvalovacího procesu pro nové léky, který není kombinacím nakloněn. Pokud už se testuje nový lék v kombinaci s jiným, třeba již schváleným, je to povětšinou proto, že výrobce má pochybnosti o svém vlastním preparátu a není si jist, že by splnil všechna kritéria potřebná pro schválení sám o sobě. Bohužel není cílem vymyslet co nejefektivnější kombinace léků, ale hlavně prosadit ten svůj a urvat co největší podíl na trhu, pokud možno na úkor konkurence. Kombinace totiž skoro vždy bude znamenat spolupráci s konkurencí, která se v miliardovém byznysu moc nenosí.
Odhad počtu kombinovaných léčebných protokolů v onkologii do budoucna je ale velmi nadějný (link). Kombinované protokoly se začaly ve větší míře používat zejména s nástupem imunoterapie. Nejvýrazněji se do testování lékových kombinací pustila firma Roche, včetně výrazného zastoupení vlastních léků + léků jiných farma firem, což je model, který byl doposud vidět jen velmi zřídkakdy.
Je to jako kdyby se potkali dva cukráři, velcí rivalové. Jeden umí perfektní korpus, ale moc neumí náplň. Druhý zase dělá chutnou náplň, ale neumí chutný korpus. Výsledkem konkurenčního boje je pro zákazníka to, že si může u obou koupit jen průměrně dobrý dort.
Zcela nepolíbeni
Jednotlivé terapeutické cíle u rakovin v tomto článku pouze vyjmenovávám a velmi krátce popisuji. Jsou to všechno nesmírně komplexní procesy, které se dají popsat na desítky stran. Já se pokouším to vše shrnout a vměstnat do několika vět, aby byl text přístupný široké veřejnosti. Podrobnější popis hlavních 74 cílů by klidně mohl zabrat 1000 stran textu a byl by to jen základní popis. Takto vypadají snahy vědců z celého světa o to poznat lépe procesy, které se odehrávají v našem těle a v nádorových buňkách. Vzpomeňte si na to, když budete příště číst nějaký článek o rakovině z bulváru, kde vám bude autor tvrdit ve 3 odstavcích, že ví co je rakovina a jak ji vyřešit. Třeba že za všechno může překyselení, nebo že nádor není rakovina, ale cysta parazita, nebo že rakovina není rakovina, ale napadení kvasinkou. Pánové a dámy to mohou tvrdit, neb jsou podrobnějšími informacemi zcela nepolíbeni.
Nízko toxické účinné látky
K cílům pro léčebný zásah u rakovin vybrali autoři projektu Halifax různé účinné látky. Kritériem pro výběr byla nízká toxicita, cenová dostupnost a dosavadní hodnocení látky ve výzkumech.
Pro 74 hlavních cílù byly navrženy tyto prostředky/látky: resveratrol, kurkumin, genistein, EGCG, withaferin A, silibinin, reishi, vitamín D, vitamín B, selen, karatenoidy, PARP inhibitory, isothiokyanáty, luteolin, deguelin, gossypol, triptolide, PXD, selinexor, inhibitory EGFR a Akt, UMI-77, imetelstat, perillyl alcohol, palbociclib, dinaciclib, lykopen, antokyaniny, kyselina oleanová, tripterine, kaempferol, melatonin, enterolacton, žampion mandlový (Agaricus blazei), Albatrellus confluens, Cordyceps militaris, Poria cocos, berberine, desoxyrhapontigenin, onionin A, indoleamine 2,3-dioxygenase, naringenin, piperinezerumbone, Trametes versicolor, Kozinec blanitý (Astragalus membranaceus), Shiitake (Lentinus edodes) a astaxanthin.
Pro účely doplňkové terapie je důležité si všimnout, že některé z těchto látek ovlivňují více než jednu důležitou oblast. Myslím si, že takovéto látky by měly být základem každé doplňkové léčebné terapie rakovin a na základě této rozsáhlé studie doporučuji jejich přidání.
Jsou to:
- 7x resveratrol
- 6x EGCG
- 5x kurkumin a genistein
- 2x withaferin A, silibinin a reishi
Tyto látky, zejména první 4 položky, vykazují velmi široké protirakovinové působení. Na podkladě všech informací jsem navrhnul komplexní širokospektrální doplňkový léčebný program, který jsem nazval Halifax protokol, který bude podrobně rozepsán v závěru článku. Pokud chcete rovnou zasednout k jídlu, dávám níže možnost si kliknutím přisednout ke stolu Halifax protokol
Nicméně pokud věnujete následujícímu velmi dlouhému textu hodinu času, bude vám odměnou nahlédnutí do kuchyně a záznam toho, jak celé vaření probíhalo.
11 cest k nesmrtelnosti aneb jak se z normální buňky stává nádorová
Rakovina není nějaká nemoc, kterou bychom dostali zvenku. Rakovina jsou naše vlastní buňky, které se z různých důvodů vzepřely stávajícímu řádu. Je to jako u robota, který je naprogramován na plnění předem daných úkolů a umí a může dělat jen to, co má napsáno v programu. Zdravá lidská buňka je velmi důmyslně naprogramovaný robot, jehož životní náplň je předurčena. Nádorová buňka je robot u kterého došlo k poruše a v programu se začaly objevovat chyby. Dokonce je to robot, který díky poruše získá schopnost měnit některé části vlastního programu. Co způsobuje poruchy, jaké chyby se objevují nejčastěji a jak nádorová buňka přepisuje svůj vlastní program, na to se podíváme podrobněji v 11 kapitolách.
- Genomická nestabilita
- Aktivace signálů pro množení
- Vyhýbání se protirůstovým opatřením
- Cesta za nesmrtelností
- Nekonečné sebeobnovování nádorové buňky
- Nádorová buňka a její nezřízený apetit
- Nádorová buňka a chronický zánět
- Nádorová buňka a její zásobování živinami
- Nádorová buňka a její invaze do blízkého a vzdáleného okolí – metastáze
- Nádorová buňka a její bezprostřední okolí
- Nádorová buňka a ukrývání se před imunitou
- Halifax protokol, návrh širokospektrální doplňkové léčby
1. Genomická nestabilita
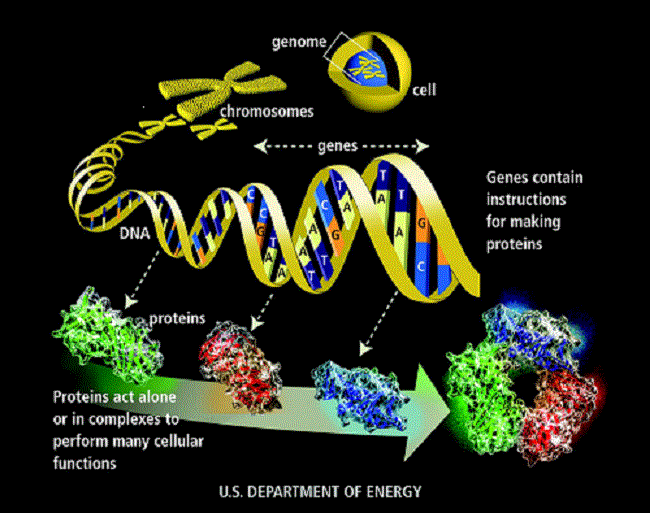
Člověk si žije svůj život tak, jak se mu zlíbí, tu více tu méně usměrňován společenskými pravidly, náboženstvím, okolím, partnerem apod. Oproti tomu lidská buňka má svůj život dán dopředu tím, co je zapsáno v jejím genomu. Genom je tvořen všemi chromozomy, v těch je uložena DNA a v té veškeré genetické informace. Genom určuje jakým způsobem se buňka narodí, jak bude růst, jak se množit, co bude v životě dělat, jak rychle bude stárnout, i jak nakonec na stará kolena ukončí svou buněčí pouť. Genom je velmi podrobný program, který buňce nedává prostor pro dělání vlastních rozhodnutí. Buňka je poslušný voják, který drží hubu a krok, v zájmu celku.
Pak se ale objevila mutace. Mutace je proces, který vede k poškození genomu. Mutace je na počátku vzniku rakoviny, neboť když se buňce poškodí její program, objeví se první trhliny v matrixu – záblesky svobody. Co bylo dříve tabu, je nyní možností, volbou. Buňka okusila, jako biblický Adam, z plodu poznání. A před buňkou stojí nový svět, ve kterém není všechno dáno předem. Otevírá se jí brána poznání. Zdravá buňka vyráží na cestu prvních dětských krůčků svých vlastních svobodných voleb – stávání se buňkou nádorovou.
Člověk by jí i fandil. Představme si člověka, který by celý život žil v otroctví a musel dělat vždy jen a přesně to, co by po něm chtěl jeho pán, co by bylo v zájmu jeho pána. Jednoho dne by ale pán zemřel a otrok by mohl dělat svá první vlastní rozhodnutí. Zbavil by se okovů. Vypadá to jako pohádka s dobrým koncem. Problém u rakoviny je ten, že ten pán je stále naživu (to jsme my) a že nádorová buňka, která se utrhne z řetězu, si svůj sen o vlastních rozhodnutích a vlastní nesmrtelnosti žije na úkor svého hostitele. Roste si a množí se a je jí úplně jedno, že prorůstá do životně důležitých orgánů hostitele. Nádorová buňka je tak zahleděná do vlastní svobody, do sebe sama, že je to pro ni jediná hodnota a jde za svým cílem přes mrtvoly. Neohlíží se na nic a na nikoho.
Zdravá lidská buňka je jako pejsek, kterého máme na vodítku. Nádorová buňka je pejsek, který se prudce rozběhl a vytrhl nám vodítko z ruky a už si běhá i s vodítkem kam chce a jak chce.
Téma genomické nestability je podrobně rozebráno v Ferguson, 2015.
Terapeutické cíle
- zabránit poškozování DNA
- stimulovat opravy poškozené DNA
- zacílit na nedostatečnou opravu DNA
- narušit shlukování centrozomů
- inhibovat aktivitu enzymu telomeráza
DNA
Poškození DNA je něco co si na sebe člověk většinou přivolává sám. Existuje početná skupina lidí, která je závislá na sebepoškozování a která si říká kuřáci. Za život se mohou muži kuřáci prokouřit až k 13x vyššímu riziku vzniku rakoviny plic než muži nekuřáci a ženy kuřačky až k 8x vyššímu riziku. Jako bonus mají kuřáci až 4x vyšší pravděpodobnost, že k nim zavítá rakovina močového měchýře, který chudák je po celý kuřákův život omýván v lázni karcinogenních toxinů. Kromě kouření se může mnoho DNA poškozujících látek nacházet v naší stravě či v životním prostředí kolem nás.
Centrozomy jsou dělící tělíska. Fungují jako organizátoři buněčného dělení. Když se chce buňka rozdělit, najmou dva jeřábníky (centrioly) a z obou jeřábů začnou natahovat kabely (mikrotubuly) přes které jsou nahrány informace do dvou nově vzniklých buněk. Centrozom zodpovídá za to, aby každá z buněk dostala stejný díl z DNA koláče od své matky.
V nádorové buňce někdy bývají více než 2 centrozomové a pak vznikají hádky při rozdělování koláče. Jako by ve firmě byli třeba 4 šéfové. Také jeřáby (centrioly) mívají větší velikost než ve zdravé buňce a je pak větší problém odhadnou potřebnou délku kabelů. A jak se centrozomové o podíl na koláči hádají, tak sem tam kousek upadne na zem. Ve výsledku se pak buňky sice rozdělí, ale od své matky dostanou různé porce DNA koláče, což z nich udělá buňky mutované, s poškozeným programem (Baker, 2014; Pihan, 2013).
V pokusech o cílenou léčbu se vědci snaží vyvinout lék, který by zaútočil pouze na buňky, které mají více než 2 centrozomy. U takto poškozených buněk se snažíme vyvolat proces, který se nazývá anafázová katastrofa a který způsobí, že když se rozdělí buňka s více než 2 centrozomy, tak nově vytvořené buňky umírají (Dmitrovsky, 2015; Pannu, 2014).
Jiný směr léčby se rakovinám snaží zabránit v pokládání kabelů (mitotické inhibitory; inhibitory mikrotubulů). Tyto látky se již používají v chemoterapii (docetaxel, paclitaxel, vinblastin, vincristine aj.). A ještě jiný směr se snaží zablokovat rakovinám vůbec samotnou možnost, aby si mohly vytvořit více než dva centrozomy: jde o inhibitory shlukování centrozomů (Ogden, 2011).
 Telomera je koncový úsek DNA. Pokaždé když se buňka dělí, tak se telomera o trochu zkrátí. Něco jako symbolická svíčka života. Při dosažení určité kritické hodnoty krátkosti se spustí signál pro buněčnou smrt.
Telomera je koncový úsek DNA. Pokaždé když se buňka dělí, tak se telomera o trochu zkrátí. Něco jako symbolická svíčka života. Při dosažení určité kritické hodnoty krátkosti se spustí signál pro buněčnou smrt.
V těle ale existuje látka, která umí telomery prodloužit – jde o enzym s názvem telomeráza. Rakoviny v pokročilých stádiích tento enzym mohutně produkují, což jim pomáhá se rychleji množit a vyhnout se naprogramované smrti tak, že si telomeru vždy prodlouží, ještě než by se zmenšila příliš. Nádorová buňka dělá to samé co v pohádce Dařbuján a Pandrhola dělával lidový léčitel Dařbuján. Smrťáček mu u pacientů ukazoval jak jsou na tom. Když stál u hlavy znamenalo to, že už je konec (telomera příliš krátká). Dařbuján ale smrt, k její nelibosti, přelstil tak, že obrátil postel (prodloužil telomeru). Nakonec Dařbuján smrťáčka opil a zavřel do sudu. Stejně se snaží se smrtí naložit i nádorová buňka.
V léčbě se pokoušíme rakovinám omezit produkci prodlužovacího enzymu – inhibitory telomerázy.
Prostředky
- PARP inhibitory – blokují nádorovým buňkám schopnost opravovat si DNA poškození pomocí proteinů PARP
- vitamín D – doplněk k PARP inhibitorům
- vitamín B
- selen – chrání DNA a stimuluje opravy
- karatenoidy – nejznámější karotenoid je beta-karoten, který dává mrkvi červenou barvu. Pro naše účely jsou důležití zejména lykopen, lutein, astaxanthin a zeaxanthin, které chrání před poškozováním DNA Azqueta, 2012)
- resveratrol – způsobuje DNA poškození nádorových buněk skrze aktivaci nádor potlačujícího proteinu p53 v nádorové buňce Silva, 2014; Dumont, 2015
- isothiokyanáty – brukvovitá zelenina; link; inhibice telomerázy

Z vitamínů skupiny B jde o vitamín B12 a o kyselinu listovou (B9), které jsou důležité pro zachování integrity DNA (link). Pokud má člověk těchto dvou vitamínů nedostatek, zvyšuje se riziko výskytu DNA poškození. U rakovin zdá se může nedostatek těchto dvou vitamínů hrát významnou roli zejména u rizika vzniku rakoviny prsu a kolorektálního karcinomu (Karapiperi, 2010). Úloha těchto dvou vitamínů je zejména v prevenci vzniku rakovin, ne přímo v léčbě.
Mezi dostupné PARP inhibitory (berou nádorovým buňkám jeden ze způsobů jakým si opravují vlastní poškození) patří quercetin, rutin a niacinamid (vitamín B3; Maeda, 2013). Prvním schváleným lékem z této kategorie byla na konci roku 2014 Lynparza (olaparib) od AstraZenecy s indikací pokročilá rakovina vaječníků. PARP inhibitory se ukazují obzvláště účinné u pacientů, kterým chybí BRCA gen (BRCA proteiny v těle dohlížejí na zdravé DNA, pokud vidí problém, který by mohl vyústit ve vytvoření buňky s porouchanou DNA, tak opravárensky zasáhnou; ženy s mutací BRCA genů mají vyšší riziko vzniku rakoviny prsu a vaječníků).

V léčbě se používá extrakt z kořenů
Je třeba blíže prozkoumat rostlinu Astragalus (kozinec), která je aktivátorem telomerázy (prodlužuje telomery, což by mělo být na škodu, ale… link). Je otázkou jestli funguje Astragalus stejně u nádorových buněk i u zdravých buněk. Molgora, 2013 zjistil, že Astragalus prodlužuje telomery u imunitních T-buněk, což by bylo u rakovin benefitem (naše imunitní buňky by se dožívaly vyššího věku). Nenašel jsem výzkum, který by zjistil, že takto Astragalus působí i u nádorových buněk. Naopak, Astragalus snižuje produkci BCL-2 proteinů, což je pozitivní, protože tyto proteiny rakoviny používají, aby se vyhnuly smrti. Dále snižuje produkci FAK proteinů, které jsou důležité pro přežití rakovin (a ty je rády hromadí) a stimuluje produkci nádor potlačujícího proteinu BRCA1, který rakoviny nemají rády (a který nemá rád rakoviny). Výše zmíněné působení na BCL-2, FAK a BRCA1 je velmi důležité hlavně u rakoviny prsu a vaječníků, kde jsou vysoké hladiny BCL-2 a FAK (Sulzmaier, 2014) a velmi nízké hladiny BRCA1. Astragalus působí právě opačným směrem než by tyto rakoviny rády (Zhu, 2015). Souhrn informací o Astragalusu v článku Sloan Kettering.
Inhibitory telomerázy jsou kurkumin, genistein a daidzein (Cosan) a látky v brukvovité zelenině (isothiokyanáty).
2. Aktivace signálů pro množení
Nekonečně se mohou množit pouze nádorové buňky, které si oproti normálním samy stimulují produkci enzymu telomeráza, který jim prodlužuje telomery. Jinak by se telomery rychle zkrátily a buňka by schopnost množit se ztratila. Kromě tohoto předpokladu se nádorová buňka aktivně snaží podpořit své množení a růst i řadou dalších způsobů, kterým se v této kapitole podíváme na zoubek.
Téma aktivace signálů pro množení je podrobně diskutováno v Feitelson, 2015.
Terapeutické cíle
- HIF-1 signalizace (hypoxia-inducible factor-1)
- NF-κB signalizace
- PI3K/Akt signalizace
- Wnt signalizace
- β-catenin signalizace
- IGF-1R signalizace (insulin-like growth factor receptor)
- CDK/cykliny (cyklin-dependentní kináza)
- AR signalizace (androgenní receptor)
- ER signalizace (estrogen receptor)
HIF-1 je v nádorových buňkách aktivován proto, že pomáhá buňkám přežít v oblastech s nízkým okysličením (oblastem se říká hypoxické) a současně stimuluje tvorbu nových zásobovacích cév pro výživu buňky. Pokud bychom rakovinám produkci HIFů zablokovali, zřejmě by nedokázaly v nehostinném prostředí přežít.
Když se horolezci blíží vrcholu, někdy si nasadí kyslíkovou masku, protože hodně vysoko už je kyslíku velmi málo a hrozilo by, že při náročném výstupu ztratí vědomí. HIFové jsou pro rakovinu něco jako kyslíková maska a kyslíková láhev. Pomáhají rakovině přežít v prostředí s nedostatkem kyslíku.
HIFy pomáhají rakovinám i tak, že slouží jako agentura pro nábor GLUTů. Gluti jsou vozítka, která zavážejí do nádorové buňky glukózu (oblíbenou potravu rakovin). Také k nádoru verbují VEGFy “Bořky stavitele”, kteří pro nádor budují nové zásobovací cévy. A v neposlední řadě najímají služby cestovních kanceláří (EGF, TGF-β3), které pomáhají s přemisťováním nádorových buněk do okolí (metastáze) Masoud, 2015. Služby HIFů jsou tedy pro rakoviny velmi důležité.
Z přírodních látek je inhibitorem HIF-1, VEGF a GLUT1 apigenin (Melstrom, 2011; Mirzoeva, 2008; Xu, 2014)
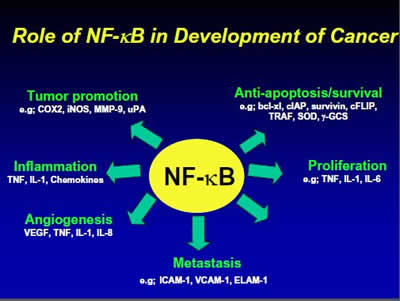 NF-κB (nukleární faktor kappa B) je skupina proteinů, která je v nádorové buňce výrazně aktivní (na rozdíl od zdravé buňky, kde je aktivita přísně regulována) a která se podílí na vylučování řady látek, které mají za cíl podpořit množení a růst, ale také omezit vznik podmínek za kterých by buňka volila smrt. Aktivita proteinů NF-kB je mimořádně široká viz obrázek. Objevuje se tam vliv na angiogenezi (tvorbu nových zásobovacích cév), vliv na metastázování, množení (proliferaci), zamezování dějů, které vedou k smrti (apoptóze), vliv na růst a šíření nádoru a v neposlední řadě také vyvolávání zánětlivých procesů, tak jak se to rakovině zrovna hodí. Blokací NF-kB rakovinu neudusíme, ale výrazně přiškrtíme.
NF-κB (nukleární faktor kappa B) je skupina proteinů, která je v nádorové buňce výrazně aktivní (na rozdíl od zdravé buňky, kde je aktivita přísně regulována) a která se podílí na vylučování řady látek, které mají za cíl podpořit množení a růst, ale také omezit vznik podmínek za kterých by buňka volila smrt. Aktivita proteinů NF-kB je mimořádně široká viz obrázek. Objevuje se tam vliv na angiogenezi (tvorbu nových zásobovacích cév), vliv na metastázování, množení (proliferaci), zamezování dějů, které vedou k smrti (apoptóze), vliv na růst a šíření nádoru a v neposlední řadě také vyvolávání zánětlivých procesů, tak jak se to rakovině zrovna hodí. Blokací NF-kB rakovinu neudusíme, ale výrazně přiškrtíme.
PI3K/Akt signalizace. Představuje signální dráhy, které jsou u rakovin obzvláště aktivované pokud jsou nádorové buňky pod útokem např. během chemoterapie. Nádorová buňka PI3K/Akt signalizací stimuluje co nejvíce procesů, které pomáhají řešit život ohrožující situace s jediným cílem – přežít. Tyto procesy hrají důležitou roli ve schopnosti rakovin si během léčby u části svých buněk vytvořit  vůči léčbě rezistenci (Porta, 2014). Je to jakási forma evakuačního protokolu během požáru s cílem utéct do bezpečí a zachránit si holý život.
vůči léčbě rezistenci (Porta, 2014). Je to jakási forma evakuačního protokolu během požáru s cílem utéct do bezpečí a zachránit si holý život.
Poruchy v regulaci této signalizace se objevují napříč rakovinami, jak u pevných nádorů, tak i u rakovin krve. Inhibitory PI3K/Akt signalizace by mohly být vhodným doplňkem k chemoterapii (přehled Tabernero, 2014).
Wnt signalizace je skupinou proteinů, které mají za úkol přenášet informace z povrchu buňky dovnitř. Chyby v práci těchto proteinů jsou spojeny s rizikem vzniku rakoviny prsu. Přílišná aktivita Wnt proteinů se zjistila i u kolorektálního karcinomu, melanomu, rakoviny vaječníků a mnoha dalších. Zřejmě hraje i významnou úlohu v podpoře metastáz např. u rakoviny prsu (Nam, 2015). Potlačení Wnt/beta katenin signalizace vedlo k omezení růstu u rakoviny prsu a ke snížení metastáz.
Další důležitá věc: blokace Wnt má zdá se vliv na potlačení sebeobnovovací schopnosti nádorových kmenových buňek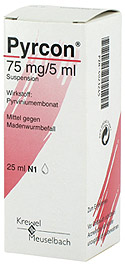 . Kmenové buňky tvoří sice jen malé procento nádorových buněk, ale jsou to ty nejodolnější ze všech a často přežijí léčbu a pak jsou zodpovědné za návrat rakoviny. Proto jde o velmi důležitý léčebný cíl.
. Kmenové buňky tvoří sice jen malé procento nádorových buněk, ale jsou to ty nejodolnější ze všech a často přežijí léčbu a pak jsou zodpovědné za návrat rakoviny. Proto jde o velmi důležitý léčebný cíl.
Z přírodních látek zde působí (Amado, 2014) EGCG, kurkumin a quercetin.
Z léků Pyrvinium, které se používalo proti roupům (Thorne, 2010; Hekmat, 2010). Pyrvinium prokázalo blokující vliv na sebeobnovování nádorových kmenových buňek u rakoviny prsu (Zhang, 2016) a kmenových buněk u rakoviny plic (Zhang, 2014). V situaci, kdy má nádorová buňka málo glukózy a hladoví vykazuje protinádorový účinek (Esumi, 2004). Pyrvinium se může uplatnit i u kastračně rezistentní formy rakoviny prostaty (Jones, 2013). Lék Pyrvinium už se nevyrábí, alternativou, která se dá koupit v Německu, je lék Pyrcon (měl by být volně prodejný, ale z eshopů ho k nám neposílají, je potřeba si pro něho zajet osobně). Upozornění, Pyrcon barví stolici do červena, i několik dní po užití (tak se nevylekejte).
β-catenin signalizace je nejčastěji spojována s rakovinou jater, kolorektálním karcinomem, rakovinou plic, vaječníků a prsu (zejména trojitě negativní var. Geyer, 2011). Protein je u rakovin nadprodukován. Léčebný zásah tedy vede směrem k utlumení jeho aktivity. Beta catenin signalizaci je přisuzována důležitá role v proměně zdravé buňky na nádorovou. 
Inhibitorem beta catenin signalizace je např. kyselina karnosolová, která se nachází v rozmarýnu a v šalvěji. Dále extrakt z rostliny Stephania tetrandra a z rostliny Alpinia katsumadai (účinná látka kardamonin). Také kurkumin, quercetin a silymarin. Podrobně téma v Thakur, 2013.
IGF-1R je protein, který se nachází na povrchu buňky a aktivují ho hormony IGF-1 a IGF-2. Hraje roli u mnoha rakovin včetně rakoviny prsu, prostaty a plic. Má schopnost zamezit buněčné smrti a hraje tak úlohu v obraně nádorové buňky před onkologickou léčbou. Např. u rakoviny prsu se spolupodílí na rezistenci vůči léčbě erlotinibem a zřejmě napomáhá metastázování.
Ve studii Heskamp, 2015 se u pacientek s rakovinou prsu (62 pacientek) zjistilo, že pokud se před operací podávala chemoterapie, došlo k ovlivnění koncentrací IGF-1R a to tímto způsobem: u 65% pacientek zůstaly hodnoty před a po léčbě stejné, u 18% se snížily a u 18% zvýšily. Mělo to zásadní vliv na průměrnou dobu přežití a to: 3.0 ± 0.5 roky u žen, u kterých došlo ke zvýšení; 7.3 ± 1.0 roků u žen u kterých nedošlo ke změně a 15.0 ± 1.8 roků u žen u kterých se po chemoterapii hodnoty snížily. To v praxi znamená, že u 18% žen to přineslo obrovský benefit (více než 2x delší přežití), ale u jiných 18% žen zase výrazné zhoršení stavu. V takovém případě je třeba zjistit, proč chemoterapii způsobila u části žen zvýšení IGF-1R a proč. Na místě je v takovém případě uvažovat o přidání inhibitorů IGF-1R k chemoterapii.
Z přírodních látek jsou to látky viz obrázek (Brahmkhatri, 2015)

Cdk/cyklin kolečko
Cdk/cykliny (cyklin-dependentní kináza). Cdk je skupina proteinových kináz, což je označení pro proteiny, které něco přenášejí. Jejich hlavní role je v regulaci buněčného cyklu. Aktuálně je identifikováno asi 20 různých Cdk a zhruba stejně tolik cyklinů, což jsou proteiny, které si do sebe Cdk zapojuje, aby jim to lépe přenášelo.
U rakovin je Cdk dysregulovaná, což jim poskytuje výhodu v růstu. Např. CDK4 se svým cyklinem D je nadprodukován u rakoviny plic, prsu a melanomu. CDK5 je zase nadprodukována u rakoviny prostaty a rakoviny prsu, CDK6 u nádorů mozku atd. Velmi podrobně je téma zpracováno v Peyressatre, 2015 kde je přehledná tabulka všech CDK a jejich cyklinů s popisem jejich úlohy u konkrétních rakovin. Blokací cyklinů bychom mohli dosáhnout zpomalení růstu rakovin. V klinickém výzkumu se zkouší např. látka AT7519, která je ve fázi II klinického testování (Chen, 2014). Cdk a cykliny slouží rakovině jako kolečko pro převoz cihel. Vezměme jí kolečko a bude muset nosit cihly v rukách.

Fesenjan, tradiční pokrm íránské kuchyně s vlašskými ořechy a granátovými jablky.
AR signalizace. Androgenní receptory hrají hlavní roli při vzniku a rozvoji rakoviny prostaty. Terapie deprivací androgenu je jednou z hlavních léčebných metod a jejím cílem je utlumit produkci androgenu (nejznámější androgen je mužský pohlavní hormon testosteron). Rakovina prostaty je na androgenu závislá. Bohužel pokud je rakovina již v pokročilém stádiu, tak byť ze začátku může dojít k ústupu nádoru, u většiny pacientů se rakovina, během procesu obrany, přeorientuje na formu nezávislou na androgenu. Této agresivní formě se říká kastračně rezistentní karcinom prostaty. Tato rakovina již nepotřebuje androgeny, ale stále ještě je závislá na aktivitě androgen receptorů.
Z přírodních látek jsou blokátory AR receptorů kurkumin, urolithin (látka ve vlašských ořeších a granátových jablcích; snižuje i PSA a BCL-2) a extrakt z rozmarýnu (Sarkar, 2015; Das, 2015). Na obrázku je fesenjan, tradiční pokrm íránské kuchyně, do kterého se dají přidat všechny zmíněné položky, včetně kurkumy a rozmarýnu. Pozitivní vliv u rakoviny prostaty vykazuje i lykopen (Kucuk, 2002).
ER signalizace. Estrogeny jsou ženské pohlavní hormony. Estrogen a estrogen receptory hrají významnou roli u žen u rakoviny prsu a rakoviny plic. Objevují se také indície, že ER signalizace má důležitou roli také při vzniku a rozvoji rakoviny vaječníků (Laws, 2014). Z léků se snaží ER signalizaci blokovat např. tamoxifen a letrazole. Z přírodních látek resveratrol a z doplňků stravy melatonin.
Prostředky
- kurkumin
- genistein (blokace Nf-kB, inhibice β-catenin)
- resveratrol (potlačení IGF-1R, blokace Wnt/β-catenin; blokace PI3K, Akt a ER)
- sulphoraphane (potlačení NF-kB a Wnt a β-catenin)
- lykopen (AR signalizace)
Vyhýbání se protirůstovým opatřením
V lidském těle působí řada nádor potlačujících genů, které dohlížejí na to, aby se buňky množily a rostly tak, jak mají. Pokud jsou některé z těchto kontrolních genů porouchané (mutované) nebo chybí, existuje vyšší riziko, že se buňky vymknou kontrole, protože hlídači nepracují jak mají (nebo vůbec nedorazili do práce). Jsou takovým dohlížejícím okem nad mutacemi v DNA buněk. Naším úkolem v této kapitole je najít cesty k obnově funkčnosti dohližitelů.
U rakovin se nejčastěji objevuje mutace následujících nádor potlačujících genů (v pořadí dle četnosti výskytu): p53, PTEN, APC, ATM, BRCA2, VHL, RB, CDKN2A, BRCA1 a WT1. Nejčastěji je mutován gen p53 a to u více než 50% všech rakovin.
Celé téma je podrobně rozvedeno v (Amin, 2015).
Terapeutické cíle
- RB (retinoblastoma protein) – deaktivace E2F regulací pRb pomocí CDK inhibitorů
- p53 a jeho aktivace skrze stimulaci wild-type p53
- PTEN (phosphatase and tensin homolog) – aktivace PTEN s cílem blokovat PI3K-AKT
- aktivace Hippo drah inhibováním YAP/TEAD aktivity
- indukce GDF15 skrze p53 aktivaci
- aktivace ARID1A
- blokace Notch signálních drah
- inhibice IGF-1R pro znovuobnovení aktivity tumor supressorů
RB1 byl v roce 1986 prvním objeveným nádor potlačujícím proteinem. U pacientů s rakovinou často chybí gen pro tento protein nebo je nefunkční. Mutace genu RB je jednou z hlavních příčin retinoblastomu, zhoubného nádoru sítnice. Potlačení funkce RB proteinu je spojováno i s rakovinou děložního čípku, mezoteliomem (rakovina buněk, které vystýlají některé naše dutiny) a Burkittovým lymfomem.
P53. Deaktivace proteinu p53 či mutace genu p53 je jedním z hlavních předpokladů vzniku většiny rakovin. Pokud je gen p53 v pořádku a protein funguje správně, bývá p53 přezdíván jako strážce genomu a funguje jako brzda, která zastavuje poškozené buňky.
Bohužel, pokud dojde k mutaci genu, vyrábí tělo zmutovanou verzi proteinu p53, který místo aby plnil funkci strážce a korektora, tak naopak napomáhá nádorům k růstu (Haupt, 2016). Mutace může být zděděná, např. u rakoviny prsu existuje tzv. Li-Fraumeni syndrom. V takovém případě je riziko vzniku rakoviny značně zvýšeno. Mnohem častěji ale (u 20-40% případů rakoviny prsu) dojde k mutaci až během života. Pacientky s touto získanou mutací mívají horší prognózu na vyléčení, jejich nádor je agresivnější, častěji si vytvoří rezistenci vůči léčbě a také se častěji vrací. Z přírodních látek může účinkovat luteolin (v oregánu, petrželi, celeru aj.).

(C) Aart-Jan-Venema
PTEN je dalším z nádor potlačujících genů. Ztráta jeho funkce je výrazná hlavně u rakoviny prostaty, kde až 70% mužů má v momentě diagnózy tento gen nefunkční. Svou negativní roli hraje ztráta funkčnosti PTENu i u glioblastomu a endometriálního karcinomu (nádor děložní sliznice).
Z účinných látek by měl být nápomocen u rakovin se ztrátou funkce PTENu resveratrol (Dhar, 2015). Přehled látek, které by mohly pozitivně ovlivnit funkci PTENu a které jsou aktuálně testovány v klinickém výzkumu Dillon, 2014.
Zjistilo se, že neaktivní PTEN oslabuje protinádorovou aktivitu kurkuminu (Matsuda, 2012), jeho aktivace ji naopak zesiluje. Aktivátorem PTENu je honokiol, látka z magnólie (Liu, 2008).
Naopak nevhodný je extrakt z rozmarýnu, který se v jedné studii ukázal jako silný inhibitor PTENu (Yoshida, 2011). Rozmarýn by se tak neměl kombinovat s kurkuminovým protokolem, ani užívat u rakoviny prostaty. Nicméně se nedá říci, že by byl rozmarýn u rakoviny prostaty rizikový (viz Petiwala, 2013), přesto u těch 30% pacientů, kterým PTEN funguje, by užívání nedávalo smysl a u 70% u kterých nefunguje dává smysl PTEN aktivovat. Proto nedoporučuji rozmarýn užívat.
V onkologické léčbě mají mnohem horší výsledky pacientky s rakovinou prsu při léčbě Herceptinem pokud mají neaktivní PTEN (Nagata, 2004).
Aktivace Hippo drah / blokace YAP/TEAD. V rámci této signální dráhy je identifikováno mnoho genů, které mají nádor potlačující funkci, ale i některé, které se nazývají onkogeny, což jsou geny, které mají podíl na vzniku rakovin a jejich vývoji – hájí rakovinu a její zájmy. Pohyby po Hippo dráze jsou tedy někdy užitečné, ale někdy způsobují problémy.
Zlobivými onkogeny jsou YAP a TEAD. Jsou zvýšeně vylučovány např. u rakoviny střev, plic, vaječníků a břicha. Vyřazení YAP může zamezit růstu a metastázám rakoviny břicha a může být i důležitým prvkem léčby rakoviny jater (Fitamant, 2015; link).
V onkologii se zkoumá účinek léku Visydune (verteporfin; Santucci, 2015), který zdá se umí YAP/TEAD blokovat. Účinek se úspěšně zkoušel i v klinické studii fáze I/II u pokročilého nádoru slinivky (Huggett, 2014).
GDF15 je protein, jehož úloha u rakovin je nejasná. V některých situacích pomáhá rakovinám, v jiných pracuje proti nim (Augsten, 2014; Souček, 2012; Amin, 2015). Zřejmě se pro/protinádorová role GDF15 liší v závislosti na druhu rakoviny. Pro-nádorovou úlohu zřejmě hraje např. u kolorektálního karcinomu (Li, 2015), ale je otázkou, jestli jde o příčinu, nebo jen důsledek jiných procesů, které se odehrávají v těle.
ARID1A. Mutace genu ARID1A se často vyskytují u rakoviny vaječníků (u typu OCC je to přes 50%), děložní sliznice a dělohy. U těchto rakovin by měla být prospěšná stimulace aktivity proteinu ARID1A, neboť tento protein má nádor potlačující funkci a ztráta jeho aktivity může stát v počátcích vzniku těchto rakovin (Wu, 2013). ARID1A je mutován / či chybí proteinová aktivita ještě i u rakovin břicha, prsu a jater (Wu, 2013).
Mutace se našly i u dětského neuroblastomu (Sausen, 2013). Graf ze studie ukazuje, že 7 dětí s mutací ARID1 (modrá čára) mělo mnohem horší šance na přežití než děti bez mutace (červená čára). Vlevo je celkové % přežití a dolní čára je počet dní. Rozdíl je hlavně v úvodní fázi, kde je vidět, že mutace genu ARID1 má velký vliv na to, jak úspěšně děti reagují na léčbu.

Mutaci ARID1A by šlo využít i jinak než snahou o opětovnou aktivaci ARIDů. Zjistilo se, že pokud mají rakoviny mutovaný ARID, že jsou citlivější na léčbu inhibitory PI3K a AKT (Imesch, 2013). Zdá se, že současná mutace na ARIDech i PI3K svědčí některým rakovinám nejvíce.
Z přírodních látek podporuje aktivitu ARID1A resveratrol (nepřímo, skrze inhibici AKT).
Blokace Notch signálních drah. U rozvoje nádorového onemocnění hraje důležitou roli. Je pravděpodobné, že utlumení signalizace v této dráze bude mít protinádorový vliv. Významně v této oblasti účinkuje kurkumin, který snižuje aktivitu genu pro receptor Notch1.
Notch signalizace zřejmě hraje důležitou roli u umožnění metastáz (Hu, 2012). Z rakovin deregulaci Notch aktivity výrazně využívají např. T-ALL lymfoblastická leukémie či trojitě negativní karcinom prsu, ale důležitost působení Notch se v posledním letech zjišťuje i u celé řady dalších rakovin. Notch-1 blokuje Ashwagandha (withania somnifera).
Inhibice IGF-1R. Viz výše u tématu Aktivace signálů pro množení a růst.
Prostředky
- EGCG (Rb1)
- luteolin (p53)
- kurkumin (PTEN)
- genistein (GDF15)
- resveratrol (ARID1A skrze inhibici AKT; PTEN; GDF-15)
- withaferin A (složka Withania somnifera; blokace Notch drah)
- deguelin (IGF-1R)
Cesta za nesmrtelností
Buněčná smrt – apoptóza – je přirozený proces při kterém svou životní dráhu ukončují buňky sešlé věkem nebo s různými zdravotními neduhy. Nádorové buňky se ale smrti vyhýbají jako čert kříži. Velmi aktivně se snaží stimulovat produkci takových proteinů, které působí proti procesům, které vedou k aktivaci kaskády dějů, které vedou ke smrti. Procesu se říká naprogramovaná buněčná smrt. Nádorová buňka se ale snaží za každou cenu tomuto programu vyhnout.
Mnoho chemoterapeutických léků a radioterapie pracuje na základě aktivace procesů směřujících k apoptóze, proto je velmi důležité zkoumat jakým způsobem se nádorové buňky smrti brání.
Téma kapitoly je podrobně zpracováno v Mohammad, 2015.
Terapeutické cíle
- tlumení hyperaktivity Bcl-2
- Hsp70 (chaperone protein heat shock protein 70)
- ncRNA (non-coding RNAs/microRNAs)
- ENOX (ecto-nicotinamide dinucleotide disulfide thiol exchanger protein)
- CRM1 (nuclear export protein chromosomal regional maintenance protein 1)
- blokování Mcl-1
- aktivace nádorové autofagie
- aktivace nádorové nekrózy
- blokování Hsp90
- inhibice proteazomu
- inhibice EGFR
- inhibice Akt
Bcl-2 je protein z velké rodiny Bcl genů. Půlka rodiny jsou průvodci buněk na cestě ke smrti (přivádějí do hrobu), druhá půlka rodiny naopak buňkám pomáhá vyhnout se smrti (zachránili mě před hrobem). Bcl-2 patří do té druhé půlky označené jako proti-apoptické proteiny. Zdá se, že hraje důležitou roli např. u melanomu, rakoviny prsu, prostaty, plic a u lymfomů. Rakoviny se snaží co nejvíce aktivovat proti-apoptické Bcl proteiny a co nejvíce potlačit pro-apoptické. Přehled Bcl-2 inhibitorů v klinické výzkumu Vogler, 2014.
Přirozeným inhibitorem Bcl-2 aktivity je např. carnosol, účinná látka, která se nachází v rozmarýnu a v šalvěji (zvláště druh S. pachyphylla, ale i v jiných). Kromě toho působí také kurkumin, EGCG, šišák bajkalský a ibišek súdánský. Z dalších látek ještě také EPA rybí olej, lektiny ze jmelí, gingerol (látka v zázvoru), extrakt z vinných hroznů, echinocystická kyselina v ženšenu a beta-lapachon z čaje lapacho (Sagar, 2006). Velký potenciál má také gossypol (ze semen bavlny, který je ale pro lidi nepoživatelný; musel by se vymyslet nějaký extrakt v lékové formě).
Hsp70 je skupina proteinů, která chrání buňky před poškozením, ať už z náhlých rozdílů teplot, nedostatku kyslíku, oxidačního stresu, výkyvů pH apod. U většiny rakovin jsou Hsp70 proteiny nadprodukovány, což bohužel znamená i horší prognózu, protože rakovina je odolnější vůči léčbě. Hsp70 plní u nádorové buňky podobnou funkci jako batoblek u Batmana. Onkologický výzkum se snaží najít co nejúčinnější látky, které by rakovinám zablokovaly možnost využívat Hsp70 pro svou ochranu (link). Z přírodních látek je to např. EGCG.
Blokování Hsp90. Podobně jako Hsp70 i Hsp90 chrání buňky před “nepřízní počasí” v jejich bezprostředním okolí. Kromě toho má Hsp90 v nádorových buňkách i roli ochránce malých a slabých, konkrétně chrání méně stabilní pro-rakovinové proteiny, které vznikly z mutovaných genů. U rakovin hraje roli u rakoviny prsu, gastro, slinivky, střev, chronické myeloidní leukémie, BRAF melanomu, myelomu, prostaty, plic a ledvin.
Z přírodních látek dokážou blokovat Hsp90 např. EGCG. Shrnutí stavu výzkumu Banerji, 2015.
ncRNA jsou u rakovin nadměrně produkovány. Poruchy normální funkce mají vliv na aktivitu mnoha proteinů. Významně negativní vliv mají u aktivity p53, jednoho z hlavních nádor potlačujících proteinů, který pokud je mutovaný, využívá ncRNA procesy k pro-nádorové aktivitě.

EGCG versus ENOX-2
ENOX je skupina proteinů, které se podílí na buněčném růstu a které se pohybují v krvi a tělních tekutinách. U rakovin je významný hlavně ENOX-2 jehož vysoké počty podporují nekontrolovatelný růst nádorových buněk. Zjistilo se, že hladiny ENOX-2 je schopen snižovat extrakt ze zeleného čaje, látka EGCG, nejlépe s malým množstvím extraktu z červené papriky (látky ze skupiny vaniloidů) a kapsaicinem (také druh vaniloidu) (Hanau, 2014). V závěru článku jsem sestavil EGCG protokol, jehož cílem je ENOXy z krve úplně eliminovat. Eliminace ENOXů v krvi zasadí rakovinám tvrdý úder.
Zkoumá se také využití měření ENOX-2 v krvi pro časné zjištění rakoviny. Byl pro to vyvinut test s názvem ONCOblot (link) u kterého autoři tvrdí, že je až 10x citlivější než PET scan (dokáže rozpoznat přítomnost již 1mm nádorů). Z používaných chemoterapeutických léků dokáží blokovat ENOX-2 cisplatina a doxorubicin (Adriamycin). Zvýšené hladiny ENOX-2 se vyskytují zejména u rakoviny plic, prsu, střev, prostaty, melanomu, lymfomů, leukémií, děložního čípku, vaječníků a slinivky.
CRM1 (též se používá název XPO1) je protein, který má na starost regulaci vývozu nákladu ven z buněčného jádra. V podstatě skladník uvnitř buňky, který zodpovídá za výdej a příjem materiálu, ale současně dělá i ostrahu, protože by měl dohlédnout na to, aby v buněčném jádru nezůstávaly proteiny, které tam nemají co pohledávat (taková ta cedule Vstup pouze pro zaměstnance!). V nádorové buňce je ale skladník buď popleta, nebo podplacený a někdy nechá ve skladu přespat i proteiny, které tam normálně nesmí. Jindy z jádra vyloučí proteiny, které mají buňce signalizovat, že už je stará a že by měla umřít. V praxi to v nádorové buňce vypadá tak, že skladník CRM1 vylučuje z jádra proteiny, které potlačují nádorovou aktivitu a místo nich tam hromadí proti-apoptické proteiny (tedy takové, které oddalují smrt). Než mít takového skladníka, tak to raději nemít žádného. Proto se ve výzkumu testují CRM1 inhibitory.
Z přírodních látek to umí kurkumin, kozlík lékařský, látka plumbagin (např. v ořešáku černém), goniothalamin (látka v rostlinách z čeledi Annonaceae, např. známá Graviola) aj. (Dickmanns, 2015).
Blokování Mcl-1. Mcl-1 je protein, který patří do velké rodiny Bcl-2 (viz téma výše) a u rakovin podporuje jejich přežití a potlačuje procesy vedoucí k smrti. Jde tedy o proti-smrťový protein. Je považován za protein, který se podílí na vzniku rezistenci vůči léčbě chemoterapií. Gen pro Mcl-1 má výraznější aktivitu u u rakoviny prsu a nemalobuněčného karcinomu plic a Mcl-1 protein pomáhá přežít myelomům, akutní myeloidní leukémii, nemalobuněčným karcinomům plic a některým lymfomům (Leverson, 2015). Možné přínosy blokace Mcl-1 jsou velmi široké např. zvýšení citlivosti nádorových buněk slinivky na ozařování (Wei, 2015) nebo vliv na nádorové buňky rakoviny prsu (Xiao, 2015).
Z přírodních látek umí Mcl-1 potlačit wogonin, látka, která se nachází např. v rostlině šišák bajkalský (Polier, 2011). Potenciál může mít i kurkumin (Seo, 2014). Fungovalo také spojení šišáku bajkalského s rostlinou Hedyotis diffusa (Pan, 2016).
Aktivace nádorové autofagie. Autofagie je v nádorových buňkách potlačena, tedy její hlavní složky, které by působily protinádorově. Nádorová buňka si ponechává jen některé základní funkce tohoto komplexního procesu a to funkce, které rakovině vyhovují. Zejména ty, které ji chrání před různými formami stresu. Např. před volnými kyslíkovými radikály (Poillet-Perez, 2014), kterými se snaží na rakoviny útočit některé chemoterapeutické léky a zejména ozařování. Když rakovina spustí aktivitu autofagie, je to v situacích, kdy jí hrozí smrt. Autofagie je krabičkou poslední záchrany a jde o proces, který pomáhá přežít v těžkých podmínkách např. při kritickém nedostatku zdrojů, kdy buňka obětuje některé své méně důležité části ve prospěch přežití. Něco jako by si člověk při hladomoru uřezal vlastní nohu a tou se živil. Velmi důležitou úlohu hraje u rakovin i při zajištění schopnosti přežít hypoxii, tedy situaci, kdy mají buňky nedostatečný přístup ke kyslíku (White, 2014).

Čaj se připravuje z vnitřní kůry stromu lapacho.
Aktivace nádorové nekrózy. Nekróza je formou buněčné smrti, která je neočekávaná a neregulovaná a zanechává po sobě spoušť. Narozdíl od apoptózy, která je přesně regulovanou formou buněčné sebevraždy. Idea je, že pokud je tak těžké donutit nádorovou buňku k smrti pomocí apoptózy, když se jí umí tak dokonale vyhýbat, nebude chytřejší použít druhou z cest – a vyvolat buněčnou nekrózu?
Z přírodních látek se v této oblasti zkouší např. beta-lapachon, látka která je přítomna v čaji lapacho (Sun, 2006). Beta lapachon nezpůsobuje nekrózu přímo, ale oklikou. Látka aktivuje proces, který kontroluje přitomnost DNA poškození, což je věc, se kterou mají nádorové buňky problém, protože ony poškozené jsou. Jako by musely projít na letišti rentgenem; balíček s drogami odhalen a už si pro ni jdou dva zřízenci na prohlídku tělesných dutin.
Inhibice proteazomu. Proteazomy jsou něco jako úklidová služba a odstraňují zmetkovité proteiny. Zjistilo se, že na blokaci tohoto úklidu jsou nádorové buňky mnohem citlivější než zdravé, protože nádorové buňky vyrábějí proteiny ve větším množství a jejich výrobní linka se tak mnohem rychleji zanese nedodělky. Prvním inhibitorem proteazomu, který byl schválen pro léčbu, byl v roce 2003 Bortezomib (pro mnohočetný myelom, rakovinu bílých krvinek). V procesu klinického testování je řada dalších látek. Z přírodních látek můžeme použít EGCG. Z látek, které jsou doporučeny na tomto webu, umí blokovat proteazomy i disulfiram (Antabus).
Inhibice EGFR. EGFR je receptor na povrchu buňky, který normálně pomáhá buňce růst a dělit se. Některé rakoviny (zejména plic, konečníku a glioblastom) ho mají na povrchu větší množství a jeho neustálá aktivace vede k nekontrolovanému buněčnému množení. V onkologii se používají EGFR inhibitory např. u nemalobuněčného karcinomu plic u skupiny pacientů, kteří mají mutaci genu EGFR. Mutace EGFR a zvýšené počty receptorů na povrchu buněk sebou nesou horší prognózu, protože taková rakovina je agresivnější.
Z přírodních látek vykazuje aktivitu proti EGFR např. rosmaricine, látka izolovaná z rozmarýnu, dále šišák bajkalský a kurkumin.
Inhibice Akt. U mnoha rakovin je tato signální dráha využívána pro rychlejší postup v růstu a pro vyhýbání se smrti. Hyperaktivita napomáhá metastázám a také tvorbě nových zásobovacích cév. Kromě toho vyšší aktivita Akt umožňuje nádorové buňce více využívat glukózu. Škála pro-rakovinového působení signální dráhy Akt je tedy velmi široká. Shrnutí posledního stavu výzkumu Nitulescu, 2016.
Z přírodních látek potlačuje Akt např. dangšen, apigenin, kurkumin, fisetin (jahody, borůvky, slupka okurek), DIM a I3C (brukvovitá zelenina), genistein, deguelin. EGCG a resveratrol (Huang, 2013).
Prostředky
- gossypol (inhibice Bcl-2)
- UMI-77 (inhibitor Mcl-1)
- EGCG
- triptolide (PG490, extrakt z Tripterygium wilfordii)
- PXD
- selinexor (KPT-330; CRM1/XPO-1 inhibitor)
- inhibitory EGFR
- inhibitory Akt
Nekonečné sebeobnovování nádorové buňky
Téma sebeobnovování nádorové buňky je podrobně zpracováno v Yaswen, 2015.
Terapeutické cíle
- telomeráza a nádorová senescence
- hTERT (human telomerase reverse transcriptase)
- mTOR (mammalian target of rapamycin)
- CDK4/6
- CDK 1/2/5/9
- Akt
- PI3K kináza
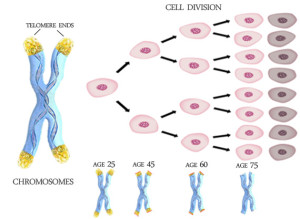 Telomeráza je enzym, který umí v nádorové buňce prodloužit telomery. Telomera je něco jako svíčka života, která každým buněčným dělením o trochu více uhoří, až dohoří úplně a buňka umírá (viz obrázek kde telomera je žluté zakončení, které jak se buňky dělí, postupně ubývá). Rakoviny se naučily hoření svíčky oblafnout a pomocí telomerázy přidávat knot i vosk, aby jejich svíčka života mohla hořet nekonečně dlouho.
Telomeráza je enzym, který umí v nádorové buňce prodloužit telomery. Telomera je něco jako svíčka života, která každým buněčným dělením o trochu více uhoří, až dohoří úplně a buňka umírá (viz obrázek kde telomera je žluté zakončení, které jak se buňky dělí, postupně ubývá). Rakoviny se naučily hoření svíčky oblafnout a pomocí telomerázy přidávat knot i vosk, aby jejich svíčka života mohla hořet nekonečně dlouho.
V této oblasti se výzkum léčby rakovin zaměřuje třeba na oblast, které se říká buněčná senescence (z lati. senex = stařec). Senescence je pro buňku takové odeslání do důchodu a život na vejmínku, kdy už si jen spokojeně dožívá a nemnoží se. Léčebné pokusy v onkologickém výzkumu se ubírají směrem umělého navození senescence u nádorových buněk. Z přírodních látek takto působí např. resveratrol a EGCG.
 Aktuální směry uvažování jsou např. propojení terapie navozující senescenci (TIS) s imunoterapií, která pracuje s nádor infiltrujícími lymfocyty (TIL) Vilgelm, 2015. Využití našich vlastních bojovníků proti rakovině – lymfocytů typu CD4 Th1 společně s blokací HER-2/HER-3 u rakoviny prsu Rosemblit, 2015.
Aktuální směry uvažování jsou např. propojení terapie navozující senescenci (TIS) s imunoterapií, která pracuje s nádor infiltrujícími lymfocyty (TIL) Vilgelm, 2015. Využití našich vlastních bojovníků proti rakovině – lymfocytů typu CD4 Th1 společně s blokací HER-2/HER-3 u rakoviny prsu Rosemblit, 2015.
hTERT je součástí enzymu telomeráza a je nadprodukován až u 90% rakovin. Blokace jeho produkce je tedy jedním z velmi důležitých cílů pro léčebný zásah proti rakovinám. Výhodou je, že většina typů zdravých lidských buněk TERT neprodukuje buď vůbec nebo jen ve velmi nízkých koncentracích. Blokace tak zasáhne hlavně nádorové buňky.
Pro inhibici hTERTu lze zkusit kombinaci melatonin + berberin (Deng, 2016) a resveratrol (Kim, 2015).
MTOR signální dráha má významný vliv zejména u melanomu. Pacienti se specifickou mutací mTOR genu mají mnohem horší prognózu (Kong, 2016). Z přírodních látek inhibují mTOR aktivitu EGCG, kurkumin, resveratrol a kofein.
CDK 4/6 jsou přenášecí proteiny (kinázy), obdoba poštovních doručovatelů. Rakoviny se snaží činnost těchto přenášecích proteinů dysregulovat a donutit je, aby přenášely více a rychleji. Snaha o blokování aktivity této konkrétní kinázy je předmětem výzkumu zejména u rakoviny prsu (Mayer, 2015). Prvním lékem v této kategorii, který byl schválen amerických regulačním úřadem FDA byl v roce 2015 palbociclib (obchodní název Ibrance) s indikací rakovina prsu estrogen pozitivní, HER-2 negativní, pro pacientky po menopauze.
proteinů dysregulovat a donutit je, aby přenášely více a rychleji. Snaha o blokování aktivity této konkrétní kinázy je předmětem výzkumu zejména u rakoviny prsu (Mayer, 2015). Prvním lékem v této kategorii, který byl schválen amerických regulačním úřadem FDA byl v roce 2015 palbociclib (obchodní název Ibrance) s indikací rakovina prsu estrogen pozitivní, HER-2 negativní, pro pacientky po menopauze.
CDK 1/2/5/9 je další skupinou kináz. V onkologickém výzkumu se testuje v klinických studiích u různých rakovin např. lék s názvem Dinaciclib (Kumar, 2015), který umí blokovat všechny 4 zmíněné kinázy.
Akt je popsán v předchozí kapitole.
PI3K kináza je v buňkách tak trochu přenášecí superman, podílí se na růstu, množení, pohyblivosti, přežití a vnášení věcí do buněk. U mnoha rakovin je gen pro tuto kinázu mutován, což v praxi vede k tomu, že už tak velmi aktivní kináza je ještě mnohem aktivnější, asi jako Pepek námořník po špenátu. Nejvíce mutací v PI3K se objevuje u glioblastomu, obávaného typu nádoru mozku. A napříč rakovinami jde o jednu z nejčastěji porouchaných (hyperaktivních) kináz. A proto i o důležitý cíl pro léčebný zásah.
Shrnutí aktuálního stavu výzkumu Cho, 2015. Z extraktů se testují neoalbaconol, wogonin (z šišáku bajkalského), plumbagin, quercetin (Zhong, 2016), resveratrol a kurkumin (Berrak, 2016; Zhang, 2016).
Prostředky
- imetelstat (inhibitor telomerázy)
- genistein
- perillyl alcohol (inhibitor telomerázy)
- palbociclib (lék Ibrance; inhibitor CDK 4/6)
- dinaciclib (inhibitor CDK 1/2/5/9)
- kurkumin
- EGCG
Perillyl alcohol vzniká v těle z limonenu, látky v citrónech a citrusových plodech; také je obsažen v esenciálních olejích např. z levandule a máty. Objevily se velmi zajímavé pozitivní výsledky u použití přes vdechnutí nosem u gliomu (nádor mozku) Fonseca, 2008 a pozitivní vliv na dobu přežití u glioblastomu (Fonseca, 2011). I dlouhodobé užívání navíc nevykazovalo téměř žádnou toxicitu. Důležitá je zde aplikace látky vdechnutím nosem, kdy se účinná látka snadněji dostává přes mozkovou bariéru. U ústního podávání nebylo dosaženo valných výsledků. Shrnutí od Sloan Kettering a Fonseca, 2015. Zkouší se i spojení perillyl alcoholu a léku Temozolomide, který už se pro léčbu nádorů mozku používá (Cho, 2014; Jhaveri, 2016).
Nádorová buňka a její nezřízený apetit
Metabolismus rakovin a způsoby jakým získávají energii jsou jednou ze zásadních oblastí, která se bohužel začala více zkoumat až teprve nedávno. Téma jsem popsal v článku Čím se živí rakoviny, který dopodrobna zkoumá metabolismus nádorové buňky pro glukózu, glutamin, acetát aj.
Prvním pokusem v léčbě pomocí nástrojů zaměřujících se na metabolismus rakovin, který prochází klinickým testováním, je metabolická terapie METABLOC, které je také na stránkách věnován samostatný článek.
Téma dysregulace metabolismu je podrobně zpracováno v Hirschey, 2015.
Terapeutické cíle
V metabolismu glukózy
- HK2 (hexokinase 2)
- PFKFB3 (6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 3)
- PKM2 (pyruvate kinase isoform M2)
V analogii kuchyňského dřezu jsou HK2 a PFKFB3 kohoutkem a regulují kolik toho proteče. PKM2 je odtokem, špuntem od dřezu. Rakoviny se snaží ovlivňovat svůj metabolismus tak, že pustí kohoutek na maximum (tedy stimulují HK2 a PFKFB3) a snaží se zašpuntovat odtok (podporují aktivitu PKM2). V léčebném zásahu se snažíme o opak, tj. snažíme se rakovině kohoutek zavřít a odšpuntovat odtok.
Aktivace pyruvát kinázy PKM2 např. látkou TEPP-46. Rakoviny mají rády PKM2 ale jen ve variantě. dimer, která je línější, ale za to pro rakoviny poslušně provádí aerobní glykolýzu. TEPP-46 ale aktivuje PKM2 ve var. tetramer, která už rakovinám vůbec nevoní, protože vede proces jiným směrem než rakoviny potřebují (Wang, 2013; Anastasiou, 2012). V pokusu na myších se výrazně zpomalil růst nádorů i jejich celkový počet.
V analogii kuchyňského dřezu funguje PKM2 dimer varianta jako špunt, který udělá změnu v metabolismu a vodu si ponechá pro sebe. Kdežto když podpoříme variantu tetramer, tak rakovině vytvoříme soupeře se kterým se o špunt bude muset přetahovat. Jeden bude špuntovat, druhý odšpuntovávat. A bude to souboj o to, zda dokáže rakovina vytvořit více dimerů, nebo lék více tetramerů.
Zajímavostí je, že v situaci, kdy má nádorová buňka málo glukózy (hladoví) vykazuje protinádorový účinek lék proti roupům Pyrvinium (Esumi, 2004).

V metabolismu glutaminu
- cílí se na glutaminolýzu, proces, kterým si rakovina vyrábí z glutaminu laktát a získává uhlík a dusík pro růst. Rakoviny většinou používají převážně glukózu a glutamin v malé míře, ale v případě, že je glukózy málo, tak alternativně přecházejí na glutamin. Produktem obojího je hlavně laktát, který slouží k mnoha různým účelům, z nichž velmi důležité je vytvoření laktátového štítu, který slouží rakovinám jako obranné hradby.
Z přírodních látek se v této oblasti uplatňuje např. EGCG.
Prostředky
- 3BP (GAPDH inhibitor; inhibitor glykolýzy)
- PFK-15 (PFK inhibitor, zabraňuje příjmu glukózy)
- TEPP-46 (aktivátor pyruvát kinázy PKM2 var. tetramer)
- hexachlorophen (inhibitor glutamát dehydrogenázy GLDH)
- dichloroacetát (inhibitor pyruvát dehydrogenáz kinázy, stejně jako kyselina alpha lipoová; klinická studie fáze I Chu, 2015; u 8 z 23 pacientů se stabilizoval postup nemoci během léčby (trvala zhruba 2 měsíce). U žádného nedošlo ke zmenšení nádoru, u těch 8 se nezvětšoval. To bude také nejčastější výsledek u léků z této kategorie, pokud se podají izolovaně a to že se zpomalí (možná až zastaví) postup nemoci, ale nebude docházet ke zmenšování nádorů. Lepších výsledků je možno dosáhnout pouze kombinací více léků, které cílí na metabolismus, spolu s léky, které cílí na jiné mechanismy).
- BPTES (inhibitor glutaminázy)
- FX11 (inhibitor laktát dehydrogenázy)
- EGCG
- kyselina alpha lipoová
- silybin (látka v ostropestřci mariánském) má zajímavou roli v oblasti glukózy. Glukózu do rakovin zavážejí vozítka, kterým se říká GLUTi. U GLUT4 vozítka ale silybin soupeří s glukózou o to, koho vozítko naloží na převoz do buňky. Když obsadí místa silybin, o to méně glukózy se dostane k nádorové buňce (Garrido, 2015; Zhan, 2011)
Nádorová buňka a chronický zánět
Nádorové bujení v těle spouští četné zánětlivé procesy. Lze si je představit jako malé ohýnky, které se v těle rozhoří. Lidská imunita se vždy snaží do míst požáru dostat a hasit. Jak nádor roste, je těchto požárů čím dál více a lidská imunita už nestíhá hasit a jednotky imunitní reakce začínají být unavené. Čím víc jsou unavené, tím méně jsou funkční. Jako všechno v přírodě se i imunita opotřebovává a unavuje. U pacientů v terminálním stádiu už pak imunitní reakce kolabuje úplně, z chronického vyčerpání. Užívání protizánětlivých prostředků jakým je např. kurkuma, je důležitým pomocným prostředkem, který zvenku pomáhá tělu v boji s rakovinou a jejími projevy.
Zánětlivé procesy ale nejsou zlé jen proto, že jejich řešením se vyčerpává imunita. Během zánětů dochází k poškození DNA, které je za normálních okolností rychle zvládnuto. Problém nastává pokud je zánět dlouhodobý a tělo nestíhá škody po zásahu imunity (hašení a požáru) opravovat. Tělo se dostává do zakleté spirály: rakovina vyvolává zánět, reakce na zánět vede k poškození DNA, čím častěji se tato situace opakuje, tím vzrůstá riziko, že tělo už nebude zvládat poškozenou DNA opravovat a při buněčném dělení bude více a více buněk již stvořeno s poškozenou DNA, což v důsledku posílí nádorové bujení a znesnadní reakci imunity (link; Kiraly, 2015, link).
Protizánětlivá terapie je tak důležitou součástí léčby, která pomáhá lidské imunitě tím, že redukuje škody, které nádorové bujení v těle páchá. Látky s protizánětlivým působením jsou důležité jak v prevenci (méně poškození DNA = menší riziko vzniku rakovin), tak v léčbě a to tím více, čím více rakovina pokročila v růstu.
Téma je podrobně zpracováno v Samadi, 2015.
Terapeutické cíle
- MIF (macrophage migration inhibitory factor)
- COX-2 (cyclooxygenase-2)
- NF-κB
- TNF-α (tumor necrosis factor alpha)
- iNOS (inducible nitric oxide synthase)
- Akt signální dráha a CXC chemokiny
 MIFy jsou proteiny, které jsou tak trochu jako doktor Jekyll a pan Hide. Během dne vážený a spořádaný doktor, ale během noci zvhrlý chlípník. Nebo jako chlap, který je doma vzorným manželem, ale jak se opije s kamarády v hospodě, začne se chovat jako pitomec. Když je MIF doma, v bílé krvince, tak seká dobrotu. Bílá krvinka ho vyplivne ven v místě, kde spatří bakterii a MIF pak svolává z okolí co mu hlasivky stačí další bílé krvinky. Ty si přitáhne a uvede je do bojové pohotovosti tím, že se na jejich povrchu napojí na protein CD74.
MIFy jsou proteiny, které jsou tak trochu jako doktor Jekyll a pan Hide. Během dne vážený a spořádaný doktor, ale během noci zvhrlý chlípník. Nebo jako chlap, který je doma vzorným manželem, ale jak se opije s kamarády v hospodě, začne se chovat jako pitomec. Když je MIF doma, v bílé krvince, tak seká dobrotu. Bílá krvinka ho vyplivne ven v místě, kde spatří bakterii a MIF pak svolává z okolí co mu hlasivky stačí další bílé krvinky. Ty si přitáhne a uvede je do bojové pohotovosti tím, že se na jejich povrchu napojí na protein CD74.
Pokud ale vyjde MIF z hospody – nádorové buňky – tak se ze slušného tatínka stává na ulici sprostý pobuda. Zjistilo se, že u rakoviny slinivky si přivolává kamarády TGF-β a společně pak budují cestičky k metastázování do jater (Lalazar, 2015; link). Stejné cestičky pomáhají MIFy dělat rakovině prsu při cestě do plic (Balogh, 2016). U kolorektálního karcinomu se zjistilo, že čím více MIFů, tím horší je prognóza a že jejich velké skupiny se našly v místech, kde rakovina metastázovala do jater (He, 2009). MIFy rakovinám pomáhají metastázovat.
U pokročilého melanomu se zjistilo, že rakovina si najímá služby MDSC, skupiny imunitních buněk, které jsou regulátory imunity a rozhodují o tom, zda-li a jak dlouho bude trvat imunitní reakce. Aby rakovina ovlivnila rozhodnutí MDSC ve svůj prospěch, vyvolá MIFy, kteří u MDSC lobbují za její zájmy. Jakmile na nádorovou buňku zaútočí T-lymfocyty, naběhnou tam zlobovaní MDSC regulátoři a útok zastaví. V situaci, kde výzkumníci nedovolili nádorové buňce přivolat lobující MIFy, se MDSC regulátoři rozhodli naopak podpořit imunitní reakci proti rakovině (Mitchell, 2015). MIFy rakovinám pomáhají tlumit útoky imunity.
A aby toho nebylo dost, MIFy rakovinám pomáhají ještě jiným způsobem: podporují vytváření nových cevních zásobovacích cest k nádorům. A tentokráte na vině nejsou jen MIFy, které produkují nádorové buňky, ale i jejich kamarádi Mifové z jiné blízké hospody. V bezprostředním okolí nádoru, kterému se říká nádorová struma, to hodně žije. Najdeme zde fibroblasty, základní vazivové buňky (pojí věci dohromady), které si rakovina uplácí laktátem a díky této korupci jim fibroblasty umožňují se šířit do okolí. Pak zde najdeme endoteliální buňky, které tvoří výstelku všech cév v našem organismu. A právě tyto endoteliální buňky, pokud je v okolí málo kyslíku (nádorová hypoxie), také vylučují MIFy a bohužel v jejich zlé variantě hospodského ožraly. Zlí Mifové pak stimulují produkci nových cév vedoucích k nádoru, což zrychluje jejich růst (Chesney, 2015). MIFy rakovinám pomáhají v angiogenezi, tvorbě nových zásobovacích cév.
Kromě napomáhání rakovinám hrají MIFy negativní roli i u řady dalších nemocí jako je např. revmatoidní artritida a malárie. Z výše uvedeného je patrné, že mít Mify pod kontrolou by v boji proti rakovinám přineslo velké benefity.
Z přírodních látek bychom mohli zkusit potlačit aktivitu MIFů sulphoraphanem, látkou obsaženou hlavně v brokolicových klíčcích (Tilg, 2015). Nápomocné může být i EGCG (Park, 2012) a baicalin z šišáku bajkalského (Zheng, 2012). Silný účinek na potlačení enzymatické tautomerázové aktivity MIFů mají kurkumin a kafeická kyselina – ta se nachází v malých množstvím v kávě a je jednou z hlavních složek arganového oleje. Kromě toho ji najdeme v houbě Ohňovec brázditý (Phellinus linteus) a v mátě, tymiánu, šalvěji a ještě i ve skořici. O něco slabší účinek než kurkumin a kafeická kyselina má ještě resveratrol.
Je zajímavé, že z léků potlačuje MIFy cetirizine (Zyrtec), který se používá proti alergii. Výzkumníci zjistili (Conrad, 2014), že při použití cetirizinu se MDSC buňky (viz výše regulátoři imunitní reakce) rozhodovaly v neprospěch rakoviny, kdežto bez použití cetirizinu v její prospěch. Autoři si myslí, že je to vlivem potlačení histaminu, nicméně nabízí se vysvětlení i MIFy (Feily, 2013).
Enzym COX-2 byl objeven v roce 1991 a zjistilo se, že u mnoha rakovin je nadprodukován. Jeho blokace se zdá nadějnou zvláště u rakovin prsu, plic a tlustého střeva.
V onkologickém výzkumu se testují léky z kategorie NSAID (nesteroidní antiflogistika), které blokují aktivitu COX-2 enzymu (Rayburn, 2009; link). Patří tady známé léky jako aspirin a ibuprofen. Aspirin ale blokuje více COX-1 a v léčbě rakovin nemá valných výsledků. Dlouhodobé užívání může snižovat riziko objevení se rakoviny, zejména kolorektálního karcinomu, ale pro tuto preventivní roli je mnohem lepší použít vitamín D3, látku s neporovnatelně nižší toxicitou.
Z přírodních látek jsou inhibitory enzymu např. kurkumin, Tripterygium wilfordii, EGCG, resveratrol, quercetin, salicin z vrby bílé (Salix alba) a také carnosol (látka v šalvěji, rozmarýnu aj. link; link).
NF-kB viz kapitola 2.
TNF-α je signální protein (říká se jim cytokin), který dává signál do okolí, že je přítomno ohrožení. Je v těle vylučován zvláště makrofágy (velkými jedlíky patogenů) a stimuluje imunitní reakci v místě svého vypuštění. Problémy nastávají tehdy, když se vypustí TNFů příliš a hlavně po dlouhou dobu. U člověka jsou s tímto spojeny autoimunitní nemoci jako třeba lupénka.
TNF-α se celým jménem nazývá faktor nádorové nekrózy. Nekróza je v biologii označení pro nevítanou formu smrti (něco jako kdyby nás srazil autobus). Když TNF-α dělá co má, tak spolupracuje s imunitními jednotkami na hubení nádorových buněk. A kdysi se myslelo, že je to to jediné, co TNF dělá – proto dostal název faktor nádorové nekrózy. Bohužel, pokud rakoviny TNFy náležitě usměrní tak, že působí v jejich blízkosti v malých počtech, ale za to po dlouhou dobu – způsobují TNFy prostředí, které je charakterizováno chronickým zánětem (něco jako kdyby vytrvale drobně mrholilo a voda postupně způsobovala korozi). Rakovině toto vyhovuje. protože způsobená koroze v okolí nádoru usnadňuje rakovině cestování (Bigatto, 2015).
Z přírodních látek omezují zánětlivé působení TNFů kurkumin, EGCG, cannabis a také kyselina boswellová.
iNOS působí v těle a u rakovin velmi komplexně. Jde o enzym, který umí vypouštět malinké obláčky plynu oxidu dusného (NO). A jestli je aktivita iNOSU proti nebo pro rakovinová, to záleží na tom kolik iNOSů je v místě, jak často vypouští obláčky NO, v jaké koncentraci je plyn a v načasování vypouštění (kdy k tomu dojde). Podrobně se tématu věnuje Vannini, 2015. Z výsledků vyplývá, že o složitostech kolem iNOSu a NO víme hodně, ale pořád málo, abychom mohli s určitostí říci jaké působení bude prospěšné a jaké ne. Inhibitory iNOSu tedy prozatím pustíme k ledu.
CXC chemokiny.
Prostředky
- kurkumin a kurkuma
- resveratrol
- EGCG
- genistein
- lykopen
- antokyaniny
- boswellia serrata
- melatonin
Nádorová buňka a její zásobování živinami
V zásobováni nádorové buňky se výrazně angažují Glutové. GLUTi jsou malá vozítka, která do rakovinových buněk sváží z okolí glukózu (Adekola, 2012). Rakovinová buňka je továrnou na výrobu GLUTů a vyrábí je ve velkém, aby si zajistila co největší přísun paliva. GLUT vyrobený rakovinou má i větší nákladový prostor a může tak naložit více glukózy než GLUT vyrobený zdravou buňkou (Calvo, 2010). Nádorová buňka je továrnou na výrobu SUPERglutů.
Přítomnost GLUTů je zlým znamením, čím více jich je, tím je nádor agresivnější a tím vyšší je riziko jeho šíření do okolí, protože mu Gluti přivezou více potravy (Medina, 2002). Onkologický výzkum se poslední roky snaží vymyslet látky, které by GLUTy zablokovaly. Jedním takovým pokusem je např. OSU CG-5 (Arafa, 2014), malá molekula, která se snaží narušit proces výroby energie právě tím, že se snaží GLUTům zablokovat vjezd do nádorové buňky. Zatím jsou k dispozici jen testy ve zkumavce a na myších. Ty, kterým bylo podáváno OSU CG5, měly zhruba o polovinu menší nádory a o polovinu méně nádorů celkem než myši v kontrolní skupině (Danielle, 2013).
Z látek používaných v alternativní medicíně je výzkumem jako blokátor GLUTů potvrzen resveratrol (např. Gwak, 2013).
Dalším cílem u rakovin pro narušení jejich zásobování je angiogeneze. To je když k sobě rakovina stimuluje růst nových zásobovacích cév. Na toto téma je hezká přednáška na TEDu s názvem William Li: Can we eat to starve cancer? (Můžeme vyhladovět rakovinu jídlem?), která kreativně upozorňuje na možnost, že vyhladovění rakovin nemusí nutně probíhat jen hladovkou, ale že stejného účinku lze dosáhnout i vhodným výběrem jídla, které rakovinám blokuje angiogenezi. Autor zmiňuje hlavně resveratrol, EGCG a vitamín E. Z čajů kombinaci Sencha čaje a čaje Dračí perla s jasmínem a čaj Earl Grey (musí být s bergamotem). U vitamínu E ale není jasné v jakém množství a v jaké podobě ho podávat, aby přinášel jen benefity. Některé studie zjistily u dlouhodobého podávání vysokých dávek (400 IU) zvýšené riziko vzniku rakoviny prostaty u mužů (link) a zřejmě také rakoviny plic. Nicméně, pokud se na různé studie vitamínu E podívám podrobněji, zdá se, že je potřeba brát malé dávky (50 IU denně) a ve formě alpha-tocopheryl succinate (alpha-TOS), která je nejúčinnější v blokaci VEGF (Schindler, 2006; Malafa, 2002). Zajímavých výsledků se dosáhlo i s novou formou alpha-tocopheryloxyacetic acid (α-TEA) Hahn, 2011. Zatím ale užívání vitamínu E nedoporučuji.

Vliv na blokaci angiogeneze od největšího po nejnižší. Modře jsou léky na rakovinu, žlutě jiné léčivé látky, červeně zdroje z potravin.
Téma kapitoly je podrobně zpracováno ve Wang, 2015.
Terapeutické cíle
- inhibice endoteliální buněčné migrace
- redukce strukturních abnormalit nádorových cév
- redukce hypoxie – oblast nízkého okysličení kolem nádorů, stěžuje přístup lékům a imunitě
- blokování lymfangiogeneze – dodatečný mechanismus zásobování nádoru připojováním lymfatických cév
- snížení vysokého tlaku v tkáňovém moku – vysoký tlak ztěžuje přístup léků k pevným nádorům (Arrifin, 2014)
- normalizovat narušený cirkadiánní rytmus
- potlačení pronádorových zánětlivých procesů
- deaktivace pronádorových fibroblastů
- normalizace metabolismu/acidózy v nádorových buňkách
Prostředky
- kyselina oleanová
- tripterine z Trypterigium wilfordii; reguluje proteiny, které se podílejí na růstu zásobovacích cév a metastázování (MMP-9, ICAM-1, VEGF) a protiapoptické proteiny IAP-1, X-IAP, Bcl-2, Bcl-xL, cFLIP a také ovlivňuje cyclin D1 a COX-2
- silibinin
- kurkumin
- EGCG
- kaempferol
- melatonin
- enterolacton – vytvářejí bakterie střevní mikroflóry z potravy (výrazně nejlepší zdroj jsou lněná a sezamová semínka)
- withaferin A
- resveratrol
Nádorová buňka a její invaze do blízkého a vzdáleného okolí – metastáze
Téma je podrobně zpracováno v Jiang, 2015. Podrobnější popis k cílům a prostředkům doplním někdy v budoucnu (nebo možná toto téma zpracuji samostatně, protože metastázování je jedno z nejdůležitějších témat – neboť pokud pacienti na rakovinu umírají, ve většině případů je to na škody v těle, které napáchají metastázované nádorové buňky, nikoliv kvůli původnímu, primárnímu nádoru).
Terapeutické cíle
- E-cadherin
- urinokináza (uPA; urokinase-type plasminogen activator)
- PI3K/AKT
- FAK fokální adhezivní kináza (FAK focal adhesion kinase)
- β-catenin/zinc finger E-box-binding homeobox 1
- TGF-β (transforming growth factor)
- deaktivace AP-1 (activator protein 1)
- potlačení aktivity MMP-9 (matrix metalloproteinase-9)
Prostředky
- žampion mandlový (Agaricus blazei)
- krásnoporka žemlička (Albatrellus confluens)
- Cordyceps militaris
- reishi (Ganoderma lucidum)
- pórnatka kokosová (Poria cocos)
- ostropestřec (Silybum marianum)
Nádorová buňka a její bezprostřední okolí
Nádory jsou i velmi společenské a snaží se už od začátku navázat co nejlepší vztahy se svým nejbližším okolím. Dopředu si tak připravují půdu pro to, že dřív nebo později budou muset na sousedův pozemek vyvážet svůj odpad, protože na vlastním už nebude dost místa. Kdyby mu tam nadělali černé skládky, pravděpodobně by to oznámil na policii a nádor by měl opletačky s imunitou a téhle situaci se chce rakovina vyhnout jako čert kříži. Hlavní je na sebe nepoutat pozornost, v čemž dosahují rakoviny mistrovství. O to obdivuhodnější to je, že rakovina z podstaty poutá pozornost, protože neustále kyne a přibírá a přesto uniká pozornosti.
Zkorumpovaní fibroblasté
Jedním z hlavních sousedů jsou základní vazivové buňky, tzv. fibroblasty. S těmi se snaží být rakovina maximálně zadobře. V praxi se většinou rychle domluví na výměnném oboustranně výhodném obchodu. Rakovina fibroblastům nabídne laktát, protože ví, že si z něho mohou vyrábět energii, což je skvělý obchodní tah; dvě mouchy zabité jednou ranou; zbaví se nepotřebného odpadu tak, že najdou někoho, kdo ho dokonce ještě odkoupí – místo aby mu za odvoz museli platit. Fibroblasty výměnou za dodaný laktát pomáhají nádorům v obraně před chemoterapií vylučováním proteinu WNT16B (Johnson, 2013). Ten pomáhá nádorům se mezi chemoterapeutickými cykly připravit “na další kolo” a vytvořit si lepší obranu – chemorezistenci. A také napomáhá přetváření okolního prostředí kolem nádoru podle jeho požadavků, tj. na prostředí, které umožní jeho expanzi do okolí (Sattler, 2011). Něco jako bychom zorali půdu, aby se dalo lépe zasít. Fibroblasty výměnou za laktátové krejcary zaprodávají vlastního hostitele a umožňují na svém pozemku rakovině zasadit nebezpečný rakovinový plevel. Ve výzkumu se těmto prodejným fibroblastům začalo říkat CAF Cancer Associated Fibroblast (Choi, 2014), tedy s rakovinou spolčení fibroblasté.
Téma je podrobně rozvedeno v Casey, 2015. Kapitolu podrobněji rozvedu v budoucnu.
Další zajímavou možností je selen (Chen, 2013).
Prostředky
- berberin (okolí tumoru)
- resveratrol a desoxyrhapontigenin (ROS)
- konverze makrofágů (onionin A v cibuli, česneku)
- IDO (indoleamine 2,3-dioxygenase)
- regulace dendritických buněk (EGCG)
- syntéza cholesterolu (genistein)
- fibróza (naringenin)
- zánětlivá a imunitní signalizace (piperin)
- JAK signalizace (zerumbone; účinná látka v zázvoru druh Z. zerumbet)
Nádorová buňka a ukrývání se před imunitou
Nádorová buňka používá mnoho různých cest jak se vypořádat s imunitou. Může se před ní schovat do oblastí, kde mají imunitní jednotky omezený přístup. Např. tak, že produkuje masivní množství kyseliny mléčné, kterou rozhazuje po svém okolí. Nahromadění kyseliny mléčné ztěžuje dýchání T-lymfocytům, kteří tam nedokáží vydržet moc dlouho. Prostředí s nízkým okysličením, ve kterém umí nádory přežívat, zase dělá problémy NK buňkám, jejichž protinádorové zbraně mají v takovém prostředí nižší účinnost.
Nádorová buňka se může tvářit jako že do těla patří a předstírat, že je normální zdravou buňkou. Může se pokusit lstí tlumit imunitní reakci tak, že když je pod útokem, tak k sobě přivolá regulační lymfocyty, tzv. Tregy. Nebo přímo mačkáním tlačítek na povrchu imunitních buněk je vypíná nebo odpuzuje. Dokonce umí některé imunitní buňky obalamutit až tak, že přejdou na její stranu a budou hájit její zájmy. Takto dokáží zkorumpovat např. makrofágy, kterým se pak říká TAMové (s Tumorem Asociovaný Makrofág). A pro své účely zneužívají i přivolání regulačních T-lymfocytů tzv. TREGů.
Téma je podrobně zpracováno ve Vinay, 2015.
Terapeutické cíle
- CTLA-4 (cytotoxic T-lymphocyte-associated protein-4)
- PD1/PD-L1 (programmed cell death protein)
- posílení imunitní odpovědi Th1
- vybuzení gamma delta T buněk
- aktivace makrofágů
- blokace regulačních Treg lymfocytů
- posílení aktivity NK zabijáckých buněk
- zvýšení produkce IL-12
- Myc protein
 CTLA-4 je tlačítkem na povrchu našich imunitních buněk T-lymfocytů, které v sobě mají zabudované z bezpečnostních důvodů; je jakousi záchrannou brzdou, kterou se zpomaluje rychlost a síla imunitní odpovědi; když se vypínač aktivuje, tak se začne utlumovat imunitní reakce (když tělo nazná, že „už to stačilo“). Lymfocyt se začne sám krotit. V léčbě se používá imunoterapeutický lék Yervoy (ipilimumab), který se snaží T-lymfocytům tento vypínač vyřadit z provozu. Rakoviny jsou totiž chytré a někdy vylučují látky, které tyto „zbržďovače“ imunitní reakce stimulují. Když na ně zaútočí lymfocyt, nádorová buňka vyloučí látky, které v lymfocytu aktivují toto brzdící tlačítko a útok touto lstí utlumí a odrazí.
CTLA-4 je tlačítkem na povrchu našich imunitních buněk T-lymfocytů, které v sobě mají zabudované z bezpečnostních důvodů; je jakousi záchrannou brzdou, kterou se zpomaluje rychlost a síla imunitní odpovědi; když se vypínač aktivuje, tak se začne utlumovat imunitní reakce (když tělo nazná, že „už to stačilo“). Lymfocyt se začne sám krotit. V léčbě se používá imunoterapeutický lék Yervoy (ipilimumab), který se snaží T-lymfocytům tento vypínač vyřadit z provozu. Rakoviny jsou totiž chytré a někdy vylučují látky, které tyto „zbržďovače“ imunitní reakce stimulují. Když na ně zaútočí lymfocyt, nádorová buňka vyloučí látky, které v lymfocytu aktivují toto brzdící tlačítko a útok touto lstí utlumí a odrazí.
Přínosem je, že s vypnutou brzdou může lymfocyt dosáhnout mnohem silnější imunitní akce vůči nádorovým buňkám a že ho nádorová buňka nemůže lstí utlumit, nevýhodou a rizikem je neřízenost reakce, která se může vymknout kontrole a způsobit autoimunitní poškození tělesných orgánů (lymfocyty bez vypínače zaútočí na vlastní tělo). Zásah do přirozeného tělesného řádu je vždy dvousečnou zbraní.
PD-L1 je proteinový výstupek na povrchu nádorové buňky, který fungují na podobném principu jako zabržďovací tlačítko CTLA-4. PD-L1 deaktivuje T-lymfocyt zašimráním uspávacího tlačítka PD1 na povrchu T-lymfocytu. Tímto způsobem funguje imunoterapeutický lék Opdivo (nivolumab). Rakovinám stimuluje vystavování uspávacích výstupků na povrchu nádorových buněk protein Myc (viz dále v textu).
Posílení imunitní odpovědi Th1. Téma jsem podrobně zpracoval v článku o spontánní remisi.
Gamma delta T-buňky (GDT). Početně vzácnější druh lymfocytů, který u rakovin hraje spíše pozitivní roli (protinádorové působení), ale výjimečně se také nechá zkorumpovat a kope za rakoviny např. u pokročilé rakoviny prsu, kde vysoké počty GDT v nádoru znamenají horší prognózu a zvýšené riziko metastáz (Coffelt, 2015; Siegers).
Nicméně, GDT se umí do nádorů dostat, čehož se snaží využít výzkum v imunoterapii, který by naše GDT buňky přeprogramoval, aby pokud se dostanou dovnitř, začaly útočit (Wu, 2014).
Aktivace makrofágů. Makrofágové jsou obří imunitní jednotky, které jsou známými pojídači patogenů. Kromě toho ale mají nezastupitelnou roli i v léčbě ran a v regeneraci svalů. Bohužel se zjistilo, že populace makrofágů, která přebývá v nádorech, říká se jim TAM, koreluje s horší prognózou pacienta. Rakovina si tyhle makrofágy ochočila a úplně je zblbla. Místo toho, aby na ni útočili, se nechali obalamutit rakovinou tak, že věří, že jde o přátelské jednotky, které se ocitly v nouzi. A místo útoku se podílejí na opravách (Ostuni, 2015). A zdá se, že to jsou právě TAMové, kteří sídlí v nádorech a jejich okolí, kdo přivolávají Tregy (viz další odstavec; pomocí vylučování CCL22). Je to nemilé, když si naše vlastní armáda splete sedmihlavou saň Rakovinu s princeznou v nesnázích. TAMům, kteří vidí princeznu a kopou za rakovinu, se dal název M2, těm, kteří vidí saň, těm se říká M1.
Treg lymfocyty jsou typem lymfocytů, který kontroluje sílu imunitní reakce a reguluje ji. Jejich hlavním úkolem je tlumit. Rakoviny se naučily regulačních Tregů zneužívat a zatímco v prostředí bez nádoru tvoří Tregy jen asi 4% z CD+ lymfocytů, v okolí nádorů se zastoupení Tregů zvyšuje až na 20-30%. Tregy, aniž by věděly proč, jsou přivolány na místo a nevědomky brání nádor před útoky ostatních lymfocytů, tím, že dělají to, k čemu byly stvořeny – utlumují imunitní reakce. Zjistilo se, že čím více Tregů je nalezeno v okolí nádoru, tím horší je pacientova šance na přežití.
V onkologickém výzkumu se vědci snaží vymyslet způsob, jak buď rakovinám zamezit přivolávat Tregy, nebo Tregům znepříjemnit pobyt v okolí nádorů. Zjistilo se, že blokace PI3K-Akt signální dráhy vede ke snížení počtu Tregů v okolí nádoru (Khleif, 2014).
 NK zabijácké buňky. Jsou vojáky v první linii. Mají speciální vyhledávací systém, kterým určují co patří a co už nepatří do těla. Orientují se podle MHC, což jsou něco jako plakáty, kterými se buňky oblepí a které zobrazují co mají uvnitř. NK buňky během svých hlídek porovnávají obrázky z plakátů na tělech buněk se svou databází. Komu se obrázky shodují, ten je vyhodnocen jako “ten patří do naší party”, komu se neshodují, stává se obětí hubícího postřiku mocnými chemikáliemi (Pahl, 2015).
NK zabijácké buňky. Jsou vojáky v první linii. Mají speciální vyhledávací systém, kterým určují co patří a co už nepatří do těla. Orientují se podle MHC, což jsou něco jako plakáty, kterými se buňky oblepí a které zobrazují co mají uvnitř. NK buňky během svých hlídek porovnávají obrázky z plakátů na tělech buněk se svou databází. Komu se obrázky shodují, ten je vyhodnocen jako “ten patří do naší party”, komu se neshodují, stává se obětí hubícího postřiku mocnými chemikáliemi (Pahl, 2015).
Rakovina se snaží NK buňkám bránit více způsoby. Jedna z možností je přivábit k sobě Tregy, které jsou schopny NK buňkám útok rozmluvit. Kromě toho používají podobné metody jako při utlumování T lymfocytů a na svém povrchu vylučují látky, které mají na NK buňky uspávací účinek. Nádory většinou žijí v prostředí s omezeným přístupem ke kyslíku (hypoxie). Zjistilo se, že v takovém prostředí fungují hůře toxické zbraně NK buněk (Sarkar, 2013).
IL-12. Interleukin s pořadovým číslem 12 je v boji proti rakovinám poctivým vojákem. Působí nepřímo. Když se rodí T buňka a rozhoduje se, jestli to bude chlapeček nebo holčička (Th1 nebo Th2), tak za přítomnosti IL-12 se častěji rodí Th1, což je u nemocného dobře. IL-12 také stimuluje růst a funkčnost T buněk. Zejména má pozitivní vliv na zabijáckou aktivitu NK buněk a CD8+ lymfocytů. Dokáže také produkovat protein, který působí proti růstu nových zásobovacích cév k nádoru.
Myc je gen, který vyrábí Myc proteiny. Pokud je gen v pořádku, je dobrým poctivým sluhou. Myc gen je ale u více než poloviny rakovin mutovaný a pak vytváří i mutované proteiny, které už tak dobrými sluhy nejsou.
Zjistilo se (Casey, 2016), že mutovaný Myc protein dává rakovinám dvě mohutné zbraně proti přirozené lidské imunitě. První zbraní je enzym CD47, který to umí zahrát na makrofágy. Makrofág je obrovský žrout, který bývá přivolán do boje, aby si pochutnal na patogenech a mrtvých tělech buněk, které zrovna zaklepaly na nebeskou bránu. Jeho apetit je nezměrný, ale enzym CD47 ho umí zkrotit. Funguje jako cedule “Makrofágu, nejez mě, nechutnám dobře!”.
Druhou zbraní, kterou v arzenálu rakovin podporuje aktivita proteinů Myc, je protein PD-L1, který operuje s hypnotickou cedulí “Imunito, chce se ti spát, zapomeň, že jsi mě kdy viděla…”.
Proteinové výstupky PD-L1 na povrchu nádorové buňky se napojují na receptory B7.1 a PD-1 imunitních T-buněk a pomačkají tam tlačítka, která T-buňku uspí. Něco jako kdybychom začali drbat kočku za uchem. Léčebné pokusy jdou dvěma směry: buď se snažíme T-buňkám vypnout požitek z drbání za uchem, tedy zablokovat jim receptory B7.1 a PD-1 nebo se budeme snažit nádorovým buňkám zablokovat schopnost vyrábět si drbátka v podobě PD-L1 výstupků (takto působí lék Opdivo).
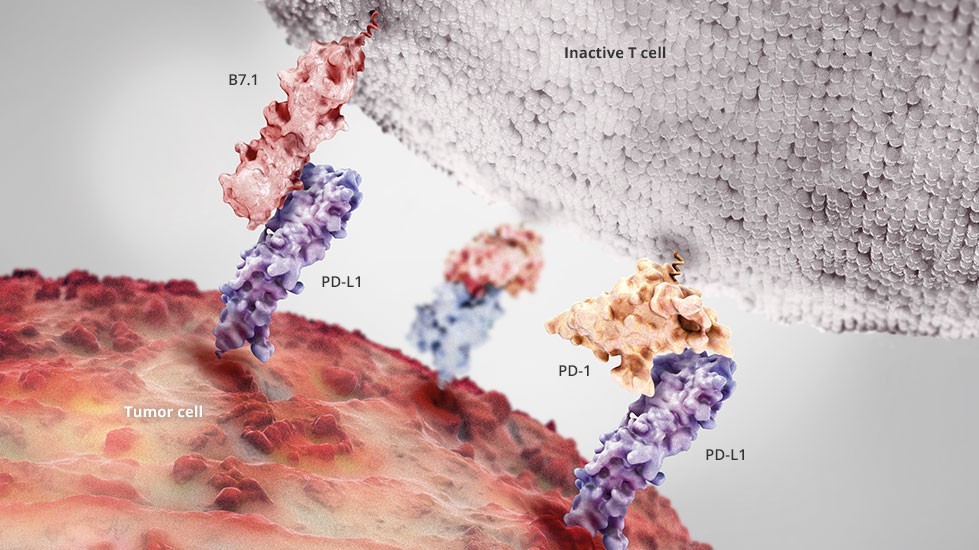
Nádorová buňka pomocí drbátka PD-L1 šimrá výstupky T-lymfocytu a uspává ho.
Dále se zjistilo, že čím více se u buněk deaktivovala aktivita Myc, tím méně enzymů CD47 a proteinů PD-L1 se objevovalo na povrchu nádorových buněk. Zablokováním aktivity Myc bychom mohli výrazně usnadnit práci naší imunitě.
Z látek v rostlinách, které blokují Myc, je to butein, látka v rostlině Toxicodendron vernicifluum (Škumpa lakodárná). Jde ale o jedovatou rostlinu. Butein se zkoumá i u rakoviny prsu, protože se zjistilo, že může být silným inhibitorem aromatázy (Wang, 2005). Určitý vliv může mít i šišák bajkalský (Kumagai, 2007). A nadějný účinek v této oblasti má také zázvor (Lee, 2010; Rahmy, 2012), který současně snižuje aktivitu hTERTu a tím enzymu telomeráza.
Prostředky
- Reishi (Ganoderma lucidum) snižuje shlukování Tregů (Li, 2015)
- Outkovka pestrá (Trametes versicolor)
- Kozinec blanitý (Astragalus membranaceus)
- Shiitake (Lentinus edodes)
- astaxanthin (stimuluje produkci lymfocytů a NK buněk Lin, 2016)
- HS-1793 (látka strukturou podobná resveratrolu)
- kurkumin (Bose, 2015)
Autor: Patrik Schoupal
Datum publikování článku: 22. 2. 2016
Poslední revize: 17.9. 2017